题目内容
14. 氧化还原滴定同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之).现有0.001000mol/L酸性KMnO4溶液和10.00mL未知浓度的无色NaHSO3溶液,反应的离子方程式是:
氧化还原滴定同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之).现有0.001000mol/L酸性KMnO4溶液和10.00mL未知浓度的无色NaHSO3溶液,反应的离子方程式是:H++2MnO4-+5HSO3-=2Mn2++5SO42-+3H2O,回答下列问题:
(1)该滴定实验所需仪器(或试剂)为下列中的ADEF(填序号).
A.酸式滴定管(25mL) B.碱式滴定管(25mL) C.量筒(10mL) D.锥形瓶
E.铁架台 F.滴定管夹 G.胶头滴管 H.漏斗 I.甲基橙试剂 J.酚酞试剂
(2)不能用碱(填酸或碱)式滴定管盛放酸性高锰酸钾溶液,试分析原因酸性KMnO4溶液会腐蚀碱式滴定管下端胶管.
(3)若滴定前平视KMnO4溶液液面,刻度为amL;滴定后俯视液面,刻度为bmL,则(b-a)mL比实际KMnO4消耗的体积少(填“多”或“少”).根据(b-a)mL计算,得到的待测液浓度比实际浓度小(填“大”或“小”).
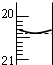
(4)若滴定前酸性KMnO4溶液刻度在“0”mL处,滴定结束时,刻度如图所示,则终点读数为20.40mL,待测NaHSO3溶液的浓度为0.005100mol/L.
分析 (1)酸性高锰酸钾具有强氧化性,实验时应用酸式滴定管,无色NaHSO3溶液显酸性,用酸式滴定管,滴定过程还需要烧杯、锥形瓶、滴定管夹和铁架台;
(2)高锰酸钾具有强氧化性能腐蚀碱式滴定管中的橡胶管;
(3)滴定后俯视液面,读数偏小;根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$×$\frac{5}{2}$分析不当操作对V(标准)的影响,以此判断浓度的误差;
(4)根据滴定管的结构和精确度以及测量的原理分析;已知反应为H++2MnO4-+5HSO3-=2Mn2++5SO42-+3H2O,MnO4-与NaHSO3的物质的量关系计算.
解答 解:(1)酸性高锰酸钾具有强氧化性,实验时应用酸式滴定管,无色NaHSO3溶液显酸性,用酸式滴定管,滴定过程还需要要锥形瓶、滴定管夹和铁架台,所以需要用到的是:酸式滴定管、锥形瓶、滴定管夹和铁架台,即ADEF;
故答案为:ADEF;
(2)高锰酸钾具有强氧化性能腐蚀碱式滴定管中的橡胶管,所以不用用碱式滴定管盛放高锰酸钾溶液,应该用酸式滴定管;
故答案为:碱;酸性KMnO4溶液会腐蚀碱式滴定管下端胶管;
(3)滴定前平视KMnO4液面,刻度为a mL,滴定后俯视液面刻度为b mL,读数偏小,则(b-a)mL比实际消耗KMnO4溶液体积少; 根据(b-a)mL计算得到的待测浓度,造成V(标准)偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$×$\frac{5}{2}$分析,c(待测)偏小;
故答案为:少;小;
(4)若滴定前酸性KMnO4溶液刻度在“0”mL处,滴定结束时,读数为20.40mL,
已知反应为H++2MnO4-+5HSO3-=2Mn2++5SO42-+3H2O,则c(HSO3-)=$\frac{c(标准)×V(标准)}{V(待测)}$×$\frac{5}{2}$=$\frac{0.001000mol/L×0.0204L}{0.010L}$×$\frac{5}{2}$=0.005100mol/L,
故答案为:20.40;0.005100mol/L.
点评 本题主要考查了滴定操作、误差分析以及计算,难度中等,理解掌握中和滴定、氧化还原滴定的原理是解题关键.

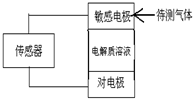 气体的自动化检测中常常应用原电池原理的传感器.如图为电池的工作示意图:气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号.下表列出了待测气体及敏感电极上部分反应产物.则下列说法中正确的是( )
气体的自动化检测中常常应用原电池原理的传感器.如图为电池的工作示意图:气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号.下表列出了待测气体及敏感电极上部分反应产物.则下列说法中正确的是( )| 待测气体 | 部分电极反应产物 |
| NO2 | NO |
| Cl2 | HCl |
| CO | CO2 |
| H2S | H2SO4 |
| A. | 上述气体检测时,敏感电极均作电池正极 | |
| B. | 检测Cl2时,敏感电极上发生还原反应 | |
| C. | 检测H2S时,对电极充入空气,对电极上的电极反应式为O2+2H2O+4e-═4OH- | |
| D. | 检测分别含H2S和CO体积分数相同的两份空气样本时,传感器上产生电流大小相同 |
| A. | 新制氢氧化铜和乙醛反应的离子方程式:CH3CHO+2Cu(OH)2+OH- $→_{加热}^{水浴}$ CH3COO-+Cu2O↓+3H2O | |
| B. | 苯酚与碳酸钠溶液反应:C6H5OH+CO32-→C6H5O-+HCO3- | |
| C. | 向含有1 mol KAl(SO4)2的溶液中加入Ba(OH)2溶液至沉淀质量最大时,沉淀的总的物质的量为2mol | |
| D. | 可以用浓盐酸酸化的KMnO4溶液与H2O2混合,以证明H2O2具有还原性: 2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
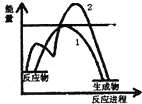 对于CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O反应有关叙述正确的是( )
对于CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O反应有关叙述正确的是( )| A. | 浓硫酸在该反应中起着降低反应活化能和提高原料转化率作用 | |
| B. | 该反应属于消去反应 | |
| C. | 如图表示放热反应的图象.曲线1表示未加催化剂, 则曲线2表示加了催化剂 | |
| D. | 该反应为放热反应,故升髙温度正反应速度减小,逆反应速度加快 |
| A. | 胶体区别于其它分散系的本质特征是具有丁达尔现象 | |
| B. | 煤的气化、石油分馏、海水制镁、海带提碘等过程中都包含化学变化 | |
| C. | 棉花和木材的主要成分都是纤维素,蚕丝、羊毛和人造丝的主要成分都是蛋白质 | |
| D. | 甲苯能够被酸性高锰酸钾溶液氧化成苯甲酸,而甲烷不反应,说明苯环能够使甲基变活泼 |


 ;反应⑦n
;反应⑦n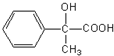 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$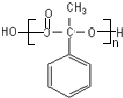 +(n-1)H2O
+(n-1)H2O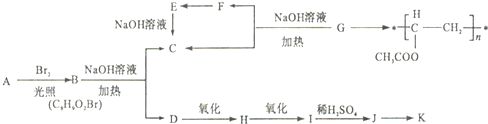
 .
. .
.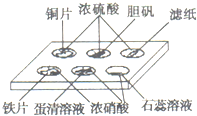 实验室常用点滴板来完成部分实验,这样可以节约药品的用量,又便于观察实验现象.图中所示的实验描述的现象正确的是( )
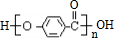
实验室常用点滴板来完成部分实验,这样可以节约药品的用量,又便于观察实验现象.图中所示的实验描述的现象正确的是( )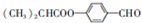 ,G的一种合成路线如下:
,G的一种合成路线如下: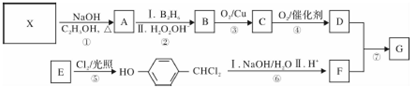
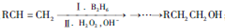 ;通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基.请回答下列问题:
;通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基.请回答下列问题: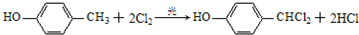 .
. .
.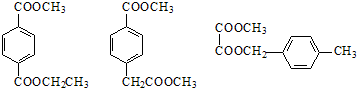 .
.