题目内容
14.下列离子方程式书写不正确的是( )| A. | AlCl3溶液与烧碱溶液反应,当n(OH-):n(Al3+)=7:2时,2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O | |
| B. | Cl2与FeBr2溶液反应,当n(Cl2):n(FeBr2)=1:1时,2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| C. | CuCl2溶液与NaHS溶液反应,当n(CuCl2):n(NaHS)=1:2时,Cu2++2HS-═CuS↓+H2S↑ | |
| D. | Fe与稀硝酸反应,当n(Fe):n(HNO3)=1:2时,3Fe+2NO3-+8H+═3Fe2++2NO↑+4H2O |
分析 A.n(OH-):n(Al3+)=6:2时,恰好生成沉淀,则当n(OH-):n(Al3+)=7:2时,又有一部分沉淀溶解;
B.Cl2先与亚铁离子反应,过量,再与溴离子反应;
C.CuCl2溶液与NaHS溶液反应,当n(CuCl2):n(NaHS)=1:2时,生成CuS和硫化氢;
D.Fe与稀硝酸反应,当n(Fe):n(HNO3)=1:2时,反应生成亚铁离子.
解答 解:A.n(OH-):n(Al3+)=6:2时,恰好生成沉淀,则当n(OH-):n(Al3+)=7:2时,又有一部分沉淀溶解,则2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O,故A正确;
B.Cl2先与亚铁离子反应,过量,再与溴离子反应,则Cl2与FeBr2溶液反应,当n(Cl2):n(FeBr2)=1:1时,2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl-,故B错误;
C.CuCl2溶液与NaHS溶液反应,当n(CuCl2):n(NaHS)=1:2时,生成CuS和硫化氢,则Cu2++2HS-═CuS↓+H2S↑,故C正确;
D.Fe与稀硝酸反应,当n(Fe):n(HNO3)=1:2时,反应生成亚铁离子,则3Fe+2NO3-+8H+═3Fe2++2NO↑+4H2O,故D正确.
故选B.
点评 本题考查离子反应方程式书写的正误判断,把握发生的反应及离子反应的书写方法为解答的关键,侧重与量有关的离子反应及氧化还原反应的考查,题目难度不大.

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
8.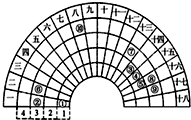 元素周期表的形式多种多样,下图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是( )
元素周期表的形式多种多样,下图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是( )
 元素周期表的形式多种多样,下图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是( )
元素周期表的形式多种多样,下图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是( )| A. | ②、⑧、⑨对应的简单离子半径依次增大 | |
| B. | ⑥的氯化物的熔点比⑦的氯化物熔点高 | |
| C. | 元素⑩处于常见周期表第四周期第VIIIB族 | |
| D. | ①分别与③、④、⑤均可形成既含极性键又含非极性键的非极性分子 |
9.下列化学过程及其表述正确的是( )
| A. | 新制氢氧化铜和乙醛反应的离子方程式:CH3CHO+2Cu(OH)2+OH- $→_{加热}^{水浴}$ CH3COO-+Cu2O↓+3H2O | |
| B. | 苯酚与碳酸钠溶液反应:C6H5OH+CO32-→C6H5O-+HCO3- | |
| C. | 向含有1 mol KAl(SO4)2的溶液中加入Ba(OH)2溶液至沉淀质量最大时,沉淀的总的物质的量为2mol | |
| D. | 可以用浓盐酸酸化的KMnO4溶液与H2O2混合,以证明H2O2具有还原性: 2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
2.下列说法正确的是( )
| A. | 胶体区别于其它分散系的本质特征是具有丁达尔现象 | |
| B. | 煤的气化、石油分馏、海水制镁、海带提碘等过程中都包含化学变化 | |
| C. | 棉花和木材的主要成分都是纤维素,蚕丝、羊毛和人造丝的主要成分都是蛋白质 | |
| D. | 甲苯能够被酸性高锰酸钾溶液氧化成苯甲酸,而甲烷不反应,说明苯环能够使甲基变活泼 |
19.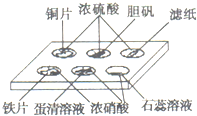 实验室常用点滴板来完成部分实验,这样可以节约药品的用量,又便于观察实验现象.图中所示的实验描述的现象正确的是( )
实验室常用点滴板来完成部分实验,这样可以节约药品的用量,又便于观察实验现象.图中所示的实验描述的现象正确的是( )
①装有铜片的孔穴中溶液呈蓝色
②装有胆矾的孔穴中固体的颜色变白
③放有滤纸的孔穴中滤纸变黑
④装有铁片的孔穴中溶液呈浅绿色
⑤装有蛋清溶液的孔穴中呈浅黄色
⑥滴有石蕊溶液的孔穴中溶液变红色.
 实验室常用点滴板来完成部分实验,这样可以节约药品的用量,又便于观察实验现象.图中所示的实验描述的现象正确的是( )
实验室常用点滴板来完成部分实验,这样可以节约药品的用量,又便于观察实验现象.图中所示的实验描述的现象正确的是( )①装有铜片的孔穴中溶液呈蓝色
②装有胆矾的孔穴中固体的颜色变白
③放有滤纸的孔穴中滤纸变黑
④装有铁片的孔穴中溶液呈浅绿色
⑤装有蛋清溶液的孔穴中呈浅黄色
⑥滴有石蕊溶液的孔穴中溶液变红色.
| A. | ①②③⑤ | B. | ①②⑥ | C. | ③⑤⑥ | D. | ②③⑤ |
6.下列说法正确的是( )
| A. | 在中和热的测定实验中,将氢氧化钠溶液迅速倒入盛有盐酸的量热计中,立即读出并记录溶液的起始温度,充分反应后再读出并记录反应体系的最高温度 | |
| B. | 向装有2mL 2mol/L AlCl3溶液的试管中,逐滴加入0.01mol/L氨水3mL,产生沉淀且沉淀不溶解,说明氢氧化铝不溶于弱碱 | |
| C. | 在Zn-Cu原电池中加入双氧水后,灯泡亮度增加且持续时间较长 | |
| D. | 海带灼烧成灰烬后,加水煮沸2~3 min并过滤,滤液中可以加入适量的H2O2来氧化I? |
3.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 0.2molAl与足量NaOH溶液反应,生成的H2分子数为0.3NA | |
| B. | 常温下,1LpH=1的盐酸溶液,由水电离的H+离子数目为0.1NA | |
| C. | 标准状况下,0.1mol氯仿的体积为2.24L | |
| D. | 11P4+60CuSO4+96H2O=20Cu3P+24H3SO4+60H2SO4反应中,6molCuSO4能氧化白磷的分子数为1.1NA |
4.CH3CH2CH2CH3(正丁烷)和(CH3)2CHCH3 (异丁烷)的关系是( )
| A. | 同分异构体 | B. | 同素异形体 | C. | 同位素 | D. | 同一种物质 |
 硼及其化合物在现代工业、生活和国防中有重要应用价值.
硼及其化合物在现代工业、生活和国防中有重要应用价值.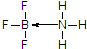 .
.