题目内容
【题目】实验室需要配制0.50 mol·L-1 NaCl溶液480 mL。按下列操作步骤填上适当的文字,以使整个操作完整
(1)选择仪器。完成本实验所必需的仪器有:托盘天平(精确到0.1 g)、药匙、烧杯、玻璃棒、________、__________以及等质量的几片滤纸。
(2) 计算。配制该溶液需称取NaCl晶体的质量为__________g。
(3)称量。
![]()
①天平调平之后,应将天平的游码调至某个位置,请在下图中用一根竖线标出游码左边缘所处的位置______:
②称量过程中NaCl晶体应放于天平的________(填“左盘”或“右盘”)。
③称量完毕,把药品倒入烧杯中。
(4)溶解、冷却,该步实验中需要使用玻璃棒,目的是___________。
(5)转移、洗涤。在转移时应使用_________ _引流,洗涤烧杯2~3次是为了__________。
(6)定容,摇匀。定容操作为__________________。
(7)下列操作对所配溶液的浓度大小有何影响?
①转移完溶液后未洗涤玻璃棒和烧杯,浓度会_____(填“偏大”、“偏小”或“无影响”,下同)。
②容量瓶中原来有少量蒸馏水,浓度会_________。
③定容时俯视,浓度会_________。
【答案】500ml容量瓶 胶头滴管 14.6 ![]() 左盘 搅拌 加快溶解 使溶质都进入容量瓶 当液面距刻度线1-2 cm处时,用胶头滴管加水到液面的凹液面的最低处与刻度相切 偏小 无影响 偏大
左盘 搅拌 加快溶解 使溶质都进入容量瓶 当液面距刻度线1-2 cm处时,用胶头滴管加水到液面的凹液面的最低处与刻度相切 偏小 无影响 偏大
【解析】
考查一定物质的量浓度溶液的配制的实验过程,包括计算、称量、溶解、转移、洗涤、定容等。再根据![]() ,判断误差分析。
,判断误差分析。
(1)配制一定物质的量浓度的溶液时,需要使用到容量瓶,配制480mL溶液,实验室中没有480mL的容量瓶,应该选用500mL容量瓶,定容时,需要使用到胶头滴管;
(2)实验室没有480mL的容量瓶,配制时要使用500mL的容量瓶,因此计算NaCl的质量时,也需要按照500mL计算。需要NaCl的物质的量为0.50 mol·L-1 ×0.5L=0.25mol,则NaCl的质量为0.25mol×58.5g·mol-1=14.625g,托盘天平的精确度为0.1g,因此称量NaCl的质量为14.6g;
(3)①如果砝码可以称量到1g,那么游码应该到0.6g,则游码的位置在0.6的位置,如图![]() ;
;
②使用托盘天平称量时,物品应该放在左盘进行称量;
(4)溶解时,使用玻璃棒用于搅拌,加速溶解;
(5)引流时,需要使用玻璃棒;洗涤玻璃棒和烧杯2~3次,全部转移到容量瓶中,是为了将所有溶质转移至容量瓶中;
(6)定容时,需要加入蒸馏水,使凹液面的最低处与刻度线相平,答案为:当液面距刻度线1-2 cm处时,用胶头滴管加水到液面的凹液面的最低处与刻度相切;
(7)①未洗涤烧杯和玻璃棒,有部分溶质没有转移至容量瓶中,浓度偏小;
②容量瓶中有少量蒸馏水,在后续操作中也需要往容量瓶中加入蒸馏水,本来就有蒸馏水,不会带浓度带来误差;
③定容时,俯视刻度线,水加少了,体积偏小,浓度偏大。

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案【题目】学习小组探究AgNO3、Ag2O(棕黑色固体,难溶于水)对氯水漂白性的影响。
实验记录如下:
| 实验 | 方案和现象 |
ⅰ | 加入1mL蒸馏水,再滴加1滴品红溶液,品红溶液较快褪色 | |
ⅱ | 加入少量Ag2O固体,产生白色沉淀a。再加入1mL蒸馏水和 1滴品红溶液,品红溶液褪色比i快 | |
ⅲ | 加入1mL较浓AgNO3溶液,产生白色沉淀b。再滴加1滴品红溶液,品红溶液褪色比i慢 |
(1)用离子方程式表示i中品红溶液褪色的原因:______。
(2)经检验,ii中的白色沉淀a是AgCl。产生AgCl的化学方程式是_______。
(3)ⅰ是iii的对比实验,目的是排除iii中______造成的影响。
(4)研究白色沉淀b的成分。进行实验iv(按实验iii的方案再次得到白色沉淀b,过滤、洗涤,置于试管中):
实验iv:
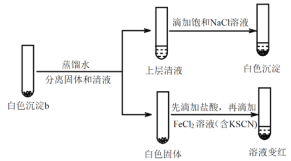
①设计对比实验证实白色沉淀b不只含有AgCl,实验方案和现象是_______。
②FeCl2溶液的作用是_______。由此判断,白色沉淀b可能含有AgClO。
(5)进一步研究白色沉淀b和实验iii品红溶液褪色慢的原因,进行实验v:
实验v:
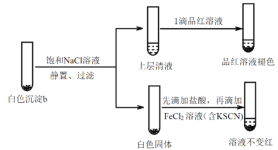
①结合离子方程式解释加入饱和NaCl溶液的目的:_______。
②推测品红溶液褪色的速率:实验iii比实验v______(填“快”或 “慢”)。
【题目】下表是元素周期表的一部分,请用化学用语回答有关问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ |
(1)⑥的氢氧化物中,所含化学键的类型是______。
(2)①和④可形成化合物,用电子式表示其形成过程______。
(3)⑦的最高价氧化物的水化物与⑧的最高价氧化物的水化物反应的离子方程式为_____。
(4)研究物质的性质差异性是学习的重要方法之一。②、③、⑧、⑨四种元素的最高价氧化物的水化物中,化学性质明显不同于其它三种酸的是______。
(5)能说明元素⑤的非金属性强于元素⑨的非金属性的实验事实是_____(填字母)。
A.两种单质的熔沸点不同
B.两种单质与氢气化合的难易程度
C.比较这两种元素的最高价氧化物的水化物的酸性