题目内容
【题目】如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极)。
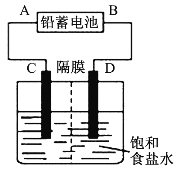
铅蓄电池充、放电时的电池反应为:Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O
2PbSO4+2H2O
(1)铅蓄电池放电时的正极反应为___。
(2)请写出电解饱和食盐水的化学方程式:____。
(3)若在电解池C极一侧滴入几滴酚酞溶液,电解一段时间后溶液变红色,说明铅蓄电池的A极为___极。
(4)用铅蓄电池电解1L饱和食盐水(食盐水足量、密度为1.15g·cm-3)时,
①若收集到11.2L(标准状况下)氯气,则至少转移电子____mol。
②若铅蓄电池消耗2molH2SO4,则可收集到H2的体积(标准状况下)为___L。
③若蓄电池消耗amol硫酸,电解后除去隔膜,所得溶液中NaOH的质量分数表达式为(假设氯气和氢气全部排出)___(用含a的代数式表示)。
【答案】PbO2+2e-+SO42-+4H+=PbSO4 2NaCl+2H2O ![]() 2NaOH+Cl2↑+H2↑ 负 1 22.4
2NaOH+Cl2↑+H2↑ 负 1 22.4 ![]()
【解析】
(1)铅蓄电池的正极为氧化铅,其电极反应方程式为PbO2+2e-+SO42-+4H+=PbSO4,故答案为:PbO2+2e-+SO42-+4H+=PbSO4;
(2)电解饱和食盐水时,氯离子和水放电,其化学方程式为2NaCl+2H2O ![]() 2NaOH+Cl2↑+H2↑,故答案为:2NaCl+2H2O
2NaOH+Cl2↑+H2↑,故答案为:2NaCl+2H2O ![]() 2NaOH+Cl2↑+H2↑;
2NaOH+Cl2↑+H2↑;
(3)若在电解池C极一侧滴入几滴酚酞溶液,电解一段时间后溶液变红色,说明产生了氢氧化钠,则C为阴极,与C相连的铅蓄电池的A极为负极,故答案为:负;
(4)①氯离子放电生成氯气,每生成1mol氯气,转移的电子的物质的量为2mol,若收集到0.5mol的氯气,则至少转移电子1mol,故答案为:1;
②根据铅蓄电池的反应方程式,若消耗2molH2SO4,转移的电子为2mol,则生成的氢气为1mol,即可收集到H2的体积(标准状况下)为22.4L,故答案为22.4;
③铅蓄电池中每消耗2mol硫酸,转移电子2mol,则电解氯化钠时生成2mol氢氧化钠、1mol氢气、1mol氯气,则若蓄电池消耗amol硫酸,生成amol氢氧化钠、![]() mol氢气、
mol氢气、![]() mol氯气,所得溶液中NaOH的质量分数为
mol氯气,所得溶液中NaOH的质量分数为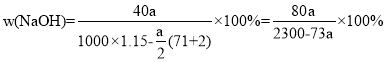 ,故答案为:
,故答案为:![]() 。
。

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案