题目内容
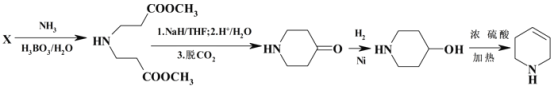
【题目】芬太尼属于管制类药物,可用作镇痛麻醉药。其合成路线如下:
已知信息: ①RX+![]()
![]()
![]()
②RCH2COOR′+R″COOR′′′![]()
![]()
③![]() + CH2=CH2
+ CH2=CH2![]()
![]()
(1)下列说法正确的是______________。
A.化合物B到C的转变涉及到的两步反应依次是加成反应、取代反应
B.化合物C具有碱性,能与盐酸反应
C.化合物F可通过化合物A一步反应制备得到
D.芬太尼的分子式是C22H28N2O
(2)化合物X的结构简式是________________________。
(3)D→E的转化过程有多个中间产物,写出D在NaH/THF条件下发生反应的化学方程式______________________________。
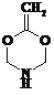
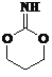
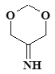
(4)有机物Y(C4H7O2N)是有机物X的含氮衍生物,同时符合下列条件的Y的同分异构体的结构简式_________________________。
①分子中有一个六元环;
②1HNMR谱和IR谱检测表明分子中有3种化学环境不同的氢原子,没有过氧键(-O-O-)。
(5)设计以NH3和X为原料制备M(![]() )的合成路线(无机试剂任选,合成中须用到上述②③两条已知信息,用流程图表示)______________。
)的合成路线(无机试剂任选,合成中须用到上述②③两条已知信息,用流程图表示)______________。
【答案】BD CH2=CHCOOCH3 
 、
、 、
、 、
、
【解析】
根据分子式及芬太尼结构简式可知A为![]() ;A和C2H4的C原子、H原子相加刚好为B的分子式(C8H10),则A到B为加成反应,B为
;A和C2H4的C原子、H原子相加刚好为B的分子式(C8H10),则A到B为加成反应,B为![]() ;由已知信息①及C的分子式可知C为:
;由已知信息①及C的分子式可知C为:![]() ;结合信息②和D到E可知,D含2个酯基,那么X含酯基,由于D到E碳原子少了三个,倒推X必为CH2=CHCOOCH3,结合信息③得出,D为
;结合信息②和D到E可知,D含2个酯基,那么X含酯基,由于D到E碳原子少了三个,倒推X必为CH2=CHCOOCH3,结合信息③得出,D为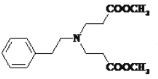 ;D到E发生信息②所示反应生成
;D到E发生信息②所示反应生成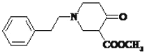 ,
, 在酸性条件下水解得到
在酸性条件下水解得到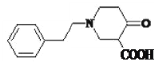 ,
, 中羧基脱CO2生成E,E为:
中羧基脱CO2生成E,E为: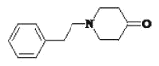 ;由F分子式可知,F为:
;由F分子式可知,F为: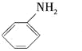 ,结合E、F、G的分子式可知,E和F发生加成反应生成G,G为:
,结合E、F、G的分子式可知,E和F发生加成反应生成G,G为: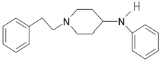 ,
,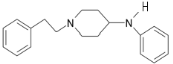 和CH3CH2COCl发生取代反应生成芬太尼
和CH3CH2COCl发生取代反应生成芬太尼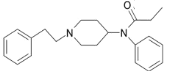 ,据此解答。
,据此解答。
(1)A.B(![]() )和氯气在光照条件下发生取代反应生成
)和氯气在光照条件下发生取代反应生成![]() ,
,![]() 和NH3在碱性条件下发生取代反应生成C(
和NH3在碱性条件下发生取代反应生成C(![]() ),故B到C发生了两步取代反应,A错误;
),故B到C发生了两步取代反应,A错误;
B.C(![]() )的官能团为-NH2,有碱性,能与盐酸反应生成盐,B正确;
)的官能团为-NH2,有碱性,能与盐酸反应生成盐,B正确;
C.A(![]() )和浓硫酸、浓硝酸共热到55℃—60℃生成
)和浓硫酸、浓硝酸共热到55℃—60℃生成![]() ,
,![]() 还原得到
还原得到 ,需要2步,C错误;
,需要2步,C错误;
D.芬太尼的分子式是C22H28N2O,D正确;
综上所述,BD正确,故答案为:BD;
(2)由分析可知,X为:CH2=CHCOOCH3,故答案为:CH2=CHCOOCH3;
(3)D( )在NaH/THF作用下发生的反应为:
)在NaH/THF作用下发生的反应为: ,故答案为:
,故答案为: ;
;
(4)X为 CH2=CHCOOCH3,含2个不饱和度,Y(C4H7O2N)比X多1个N、一个H,则Y的不饱和度也为2,分子中有一个六元环,则必有一个双键,又因为只有三种H,则2个O必然对称,即2个O在环上且对称才能满足条件,所以,满足条件的结构有: 、
、 、
、 、
、 ,故答案为:
,故答案为: 、
、 、
、 、
、 ;
;
(5)逆合成目标产物![]() 可由
可由![]() 发生消去反应而来,
发生消去反应而来,![]() 可由
可由![]() 加氢还原而来,
加氢还原而来,![]() 和题目流程中E对应,可由
和题目流程中E对应,可由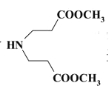 发生类似D到E的反应而来,
发生类似D到E的反应而来, 由NH3和X(CH2=CHCOOCH3)发生类似信息③的反应而来,综上所述:
由NH3和X(CH2=CHCOOCH3)发生类似信息③的反应而来,综上所述: ,故答案为:
,故答案为: 。
。