题目内容
【题目】(1)比较氧元素和氟元素的非金属性强弱:O_______F(填“<”“>或”“=”);用一个化学方程式说明两者非金属的相对强弱______________________________________。
(2)2002年1月18日在《科学》期刊中报导罗马大学的Fulvio Cacace及其同事发现氮的一种同素异形体N4,已知N4所有原子均满足8电子稳定结构。写出N4的结构式_______________。
(3)CO2和SiO2均是IVA族元素氧化物,CO2常温为气态,SiO2为高熔点固体。请分析原因_______________________________________________。
【答案】< 2F2+2H2O=4HF+O2 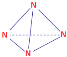 两者的结构不同,SiO2为原子晶体,CO2是分子晶体。
两者的结构不同,SiO2为原子晶体,CO2是分子晶体。
【解析】
(1)F是非金属性最强的元素,二者的非金属性强弱关系,可通过比较二者单质的氧化性来比较,即F2的氧化性比O2强,F2可以置换O2,方程式为:2F2+2H2O=4HF+O2,故答案为:<;2F2+2H2O=4HF+O2;
(2) N4所有原子均满足8电子稳定结构,则每个N原子都要与另外3个N原子相连,则N4必为正四面体结构,N原子在正四面体的顶点处,即N4的结构式为: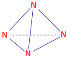 ,故答案为:
,故答案为: ;
;
(3)二者结构不同,CO2是分子晶体,SiO2是原子晶体,CO2熔化要克服分子间作用力,SiO2熔化要克服共价键,共价键比分子间作用力强,所以,SiO2的熔点比CO2高,故答案为:两者的结构不同,SiO2为原子晶体,CO2是分子晶体。

 阅读快车系列答案
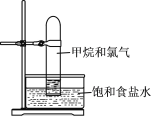
阅读快车系列答案【题目】Ⅰ. 实验室制得气体中常含有杂质,影响其性质检验。
下图A为除杂装置,B为性质检验装置,完成下列表格:

序号 | 气体 | 反应原理 | A中试剂 |
① | 乙烯 | 溴乙烷和NaOH的醇溶液加热 | _____________ |
② | 乙烯 | 无水乙醇在浓硫酸的作用下加热至170℃反应的化学方程式是_________________ | ___________ |
③ | 乙炔 | 电石与饱和食盐水反应 | _______________ |
Ⅱ. 为探究乙酸乙酯的水解情况,某同学取大小相同的3支试管,分别加入以下溶液,充分振荡,放在同一水浴加热相同时间,观察到如下现象。
编号 | ① | ② | ③ |
实验操作 |
|
|
|
实验现象 | 酯层变薄 | 酯层消失 | 酯层基本不变 |
(1)试管①中反应的化学方程式是________________________;
(2)对比试管①和试管③的实验现象,稀H2SO4的作用是______________;
(3)试用化学平衡移动原理解释试管②中酯层消失的原因_____________。
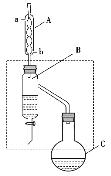
【题目】乙酸丁酯是重要的化工原料。实验室用乙酸、丁醇在浓硫酸作催化剂、加热条件下制备乙酸丁酯的装置示意图(加热和夹持装置已省略)和有关信息如下:
乙酸 | 正丁醇 | 乙酸丁酯 | |
熔点/℃ | 16.6 | -89.5 | -73.5 |
沸点/℃ | 117.9 | 117 | 126.0 |
密度/g·cm-3 | 1.1 | 0.80 | 0.88 |
下列说法正确的是( )
A.加热一段时间后,发现烧瓶C中忘记加沸石,可打开瓶塞直接加入即可
B.装置B的作用是不断分离出乙酸丁酯,提高产率
C.装置A可以装配蒸馏装置的冷凝器,且冷凝水由a口进,b口出
D.乙酸丁酯中残留的乙酸和正丁醇可用饱和碳酸钠溶液除去