题目内容
12.在标准状况下,取甲、乙、丙各30.0mL 相同浓度的盐酸,然后分别慢慢加入组成相同的镁铝合金粉末,得下表中有关数据(假设反应前后溶液体积不发生变化):| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 255 | 385 | 459 |
| 气体体积/mL | 280 | 336 | 336 |
(1)甲组实验中,盐酸(选填“过量”、“适量”或“不足量”,下同)过量;乙组实验中盐酸不足量.
(2)盐酸的物质的量浓度为1mol/L.
(3)合金中Mg、Al 的物质的量之比为1:1.
分析 (1)盐酸浓度、体积一定,甲中合金质量小于乙中合金质量,且甲中生成气体体积小于乙中气体体积,说明甲中盐酸过量、金属完全反应,乙中合金质量小于丙中合金质量,且乙、丙生成气体体积相等,说明乙、丙中盐酸完全反应,生成336mL氢气需要金属的质量为:255mg×$\frac{336mL}{280mL}$=306mg<385mg,故乙中金属剩余,盐酸不足;
(2)乙、丙中盐酸完全,可以根据反应生成氢气体积计算盐酸的物质的量浓度,根据n=$\frac{V}{{V}_{m}}$计算氢气的物质的量,根据氢元素守恒可知n(HCl)=2n(H2),据此计算;
(3)甲中盐酸有剩余,金属完全反应,此时生成氢气280mL,故可以根据甲组数据计算金属的物质的量之比,令镁、铝的物质的量分别为xmol、ymol,根据二者质量之和与电子转移守恒列方程计算x、y的值,据此解答.
解答 解:(1)盐酸浓、体积一定,甲中合金质量小于乙中合金质量,且甲中生成气体体积小于乙中气体体积,说明甲中盐酸过量、金属完全反应,乙中合金质量小于丙中合金质量,且乙、丙生成气体体积相等,说明乙、丙中盐酸完全反应,生成336mL氢气需要金属的质量为:255mg×$\frac{336mL}{280mL}$=306mg<385mg,故乙中金属剩余,盐酸不足,
故答案为:过量;不足量;
(2)乙、丙中盐酸完全,可以根据反应生成氢气体积计算盐酸的物质的量浓度,盐酸完全反应生成氢气336mL,氢气的物质的量为:$\frac{0.336L}{22.4L/mol}$=0.015mol,根据氢元素守恒可知:n(HCl)=2n(H2)=2×0.015mol=0.03mol,故盐酸的物质的量浓度为$\frac{0.03mol}{0.03L}$=1mol/L,
故答案为:1mol/L;
(3)甲中盐酸有剩余,金属完全反应,此时生成氢气280mL,故可以根据甲组数据计算金属的物质的量之比,设镁、铝的物质的量分别为xmol、ymol,根据二者质量可知24x+27y=0.255,根据电子转移守恒有2x+3y=$\frac{0.28}{22.4}$×2,联立方程解得:x=0.005、y=0.005,故合金中镁与铝的物质的量之比为:0.005mol:0.005mol=1:1,
故答案为:1:1.
点评 本题考查混合物的计算,题目难度中等,根据表中数据关系判断反应的过量问题是解答关键,试题侧重考查学生对数据的分析处理及解决问题能力.

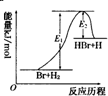
| A. | 该反应的反应热△H=E2-E1 | |
| B. | 加入催化剂,该化学反应的反应热和平衡常数变大 | |
| C. | 正反应的吸热反应 | |
| D. | 升高温度可增大正反应速率,降低逆反应速率 |
| A. | 该物质中不一定含有氧元素 | |
| B. | 该物质的分子组成必须满足n(C)=n(H) | |
| C. | 该物质中一定含有氧元素,且必须满足n(C)=n(O) | |
| D. | 该物质一定不溶于水 |
| A. | 第二种粒子是氧元素的另一种核素 | |
| B. | “四中子”的质量数为4,其质量比氢原子大 | |
| C. | “四中子”不显电性 | |
| D. | 第二种粒子的化学式为O4,与O2互为同素异形体 |
| A. | 0.1mol•L-1的CH3COOH溶液中:c(CH3COO-)>c(H+)>c(OH-) | |
| B. | 0.1mol•L的NaHCO3溶液中:c(HCO3-)>c(CO32-)>c(H2CO3) | |
| C. | 0.1mol•L的NH4Cl溶液中:c(NH4+)+c(H+)=c(NH3•H2O)+c(OH-) | |
| D. | 0.1mol•L的(NH4)2SO4溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) |
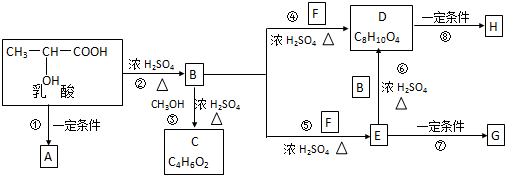
 在酸性条件下水解生成M和N:
在酸性条件下水解生成M和N: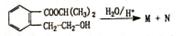
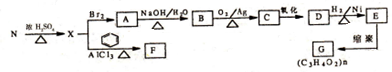
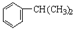 .
.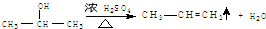 ,E转化为G的化学方程式为
,E转化为G的化学方程式为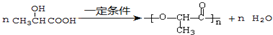 .
.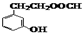 .
.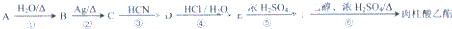
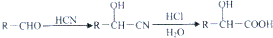
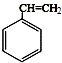 ,肉酸乙酯的结构简式
,肉酸乙酯的结构简式 .
. .
.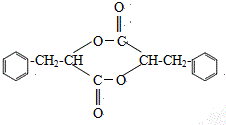 ;H是另一种副产物,它 是一种高分子化合物,形成这种物质的反应类型为缩聚反应.
;H是另一种副产物,它 是一种高分子化合物,形成这种物质的反应类型为缩聚反应.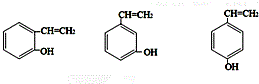 (填结构简式).
(填结构简式).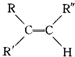 $→_{H_{2}SO_{4}}^{KMnO_{4}}$
$→_{H_{2}SO_{4}}^{KMnO_{4}}$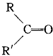 +
+
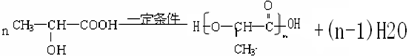 .
.