题目内容
17.某有机物除含碳氢元素外,可能含有氧元素.取该物质a g在足量O2 中充分燃烧后,在120℃下将产物全部通过足量的过氧化钠,充分反应后,过氧化钠固体质量也增加ag.则下列说法正确的是( )| A. | 该物质中不一定含有氧元素 | |
| B. | 该物质的分子组成必须满足n(C)=n(H) | |
| C. | 该物质中一定含有氧元素,且必须满足n(C)=n(O) | |
| D. | 该物质一定不溶于水 |
分析 有机物充分燃烧后生成CO2、H2O,再通过足量的Na2O2,发生反应2CO2+2Na2O2=2Na2CO3+O2中过氧化钠增重等于与CO2等物质的量的CO质量;发生反应2H2O+2Na2O2=4NaOH+O2中,过氧化钠增重等于与H2O同物质的量的H2质量,即该有机物的化学式一定满足nCO•mH2,完全燃烧后过氧化钠增重等于该物质的质量,据此结合选项解答.
解答 解:有机物充分燃烧后生成的CO2、H2O与Na2O2发生反应有:2CO2+2Na2O2=2Na2CO3+O2、2H2O+2Na2O2=4NaOH+O2,反应2CO2+2Na2O2=2Na2CO3+O2中过氧化钠增重等于与CO2等物质的量的CO质量;发生反应2H2O+2Na2O2=4NaOH+O2中,过氧化钠增重等于与H2O同物质的量的H2质量,即该有机物的化学式一定满足nCO•mH2,完全燃烧后过氧化钠增重等于该物质的质量,
A.根据分析可知,该有机物分子中一定含有氧元素,故A错误;
B.该有机物分子组成满足nCO•mH2形式即可,无法判断C、H的量,故B错误;
C.结合分析可知,该有机物分子组成满足nCO•mH2形式,则必须满足n(C)=n(O),故C正确;
D.题中信息无法判断该物质的水溶性,故D错误;
故选C.
点评 本题考查化学方程式的计算、钠的重要化合物性质等知识,题目难度中等,根据方程式得出固体增加的质量相当于CO和H2的质量为解答该题的关键,试题侧重考查学生的分析、理解能力.

练习册系列答案
相关题目
7.不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组合是( )
| 序号 | 甲 | 乙 | 丙 |
| ① | CO2 | SO2 | 石灰水 |
| ② | HCl | CO2 | 石灰水 |
| ③ | CO2 | NH3 | Ca(Cl)2 |
| ④ | NO2 | SO2 | BaCl2 |
| ⑤ | CO2 | SO2 | Ba(NO3)2 |
| A. | ②④ | B. | ①②④⑤ | C. | ①③④⑤ | D. | ①②③④ |
8.Ca(OH)2溶解度随温度变化画线如图所示,下列说法正确的是( )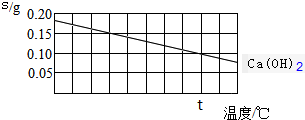

| A. | 氢氧化钙的溶解是吸热过程 | |
| B. | 温度升高时氢氧化钙溶解的速度减慢 | |
| C. | t℃时氢氧化钙的Ksp约等于2.46×10-4 | |
| D. | 向含有Ca(OH)2和Mg(OH)2两种沉淀的悬浊液中滴加NaOH浓溶液,分散系中$\frac{c(C{a}^{2+})}{c(M{g}^{2+})}$的比值不变 |
12.在标准状况下,取甲、乙、丙各30.0mL 相同浓度的盐酸,然后分别慢慢加入组成相同的镁铝合金粉末,得下表中有关数据(假设反应前后溶液体积不发生变化):
请回答:
(1)甲组实验中,盐酸(选填“过量”、“适量”或“不足量”,下同)过量;乙组实验中盐酸不足量.
(2)盐酸的物质的量浓度为1mol/L.
(3)合金中Mg、Al 的物质的量之比为1:1.
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 255 | 385 | 459 |
| 气体体积/mL | 280 | 336 | 336 |
(1)甲组实验中,盐酸(选填“过量”、“适量”或“不足量”,下同)过量;乙组实验中盐酸不足量.
(2)盐酸的物质的量浓度为1mol/L.
(3)合金中Mg、Al 的物质的量之比为1:1.
9.汽车的启动电源常用铅蓄电池,该电池在放电时的反应如下:Pb (s)+PbO2(s)+2H2SO4(aq)$?_{充电}^{放电}$2PbSO4(s)+2H2O(l),根据此反应判断下列叙述中正确的是( )
| A. | PbO2是电池的负极 | |
| B. | 负极的电极反应式为:Pb(s)+SO42-(aq)-2e -=PbSO4(s) | |
| C. | 铅蓄电池属于一次电池 | |
| D. | 电池放电时,溶液酸性增强 |
 例如:
例如: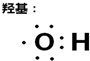
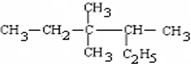 的名称3,3,4-三甲基己烷
的名称3,3,4-三甲基己烷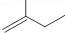 的名称2-甲基-1-丁烯.
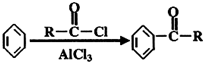
的名称2-甲基-1-丁烯.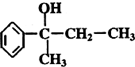 在工业上用基础的石油产品(乙烯、丙烯等)进行合成.合成A的过程可表示为:
在工业上用基础的石油产品(乙烯、丙烯等)进行合成.合成A的过程可表示为: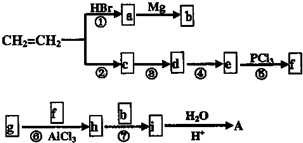

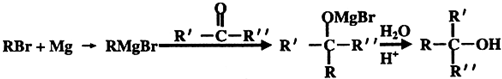
 ;
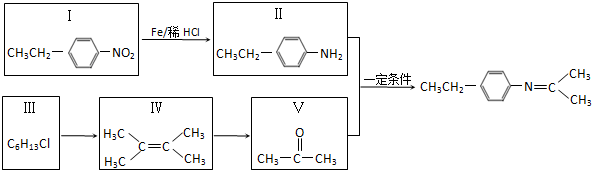
;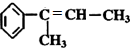 .
.
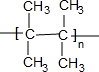 .
. (写出一种).
(写出一种).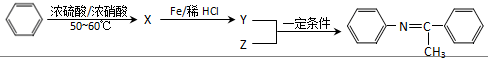
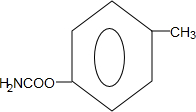
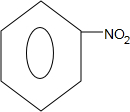 ,Z的结构简式为
,Z的结构简式为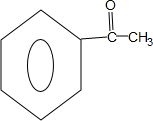 .
.