题目内容
3.已知G是一种高分子塑料, 在酸性条件下水解生成M和N:
在酸性条件下水解生成M和N: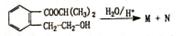
用N制取G的流程如下:
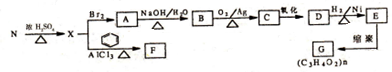
请回答下列问题:
(1)化合物E中所含两种官能团的名称是羟基、羧基.
(2)已知F的分子式为C9H12,X→F的反应类型是加成反应.若F分子中核磁共振氢谱的峰面积之比为1:1:2:2:6,写出F的结构简式
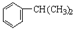 .
.(3)N转化为X的化学方程式为
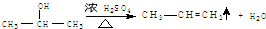 ,E转化为G的化学方程式为
,E转化为G的化学方程式为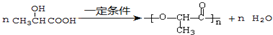 .
.(4)化合物M不能发生的反应是e(填字母代号).
a、加成反应 b、缩聚反应 c、消去反应 d、酯化反应 e、水解反应 f、置换反应
(5)同时符合下列三个条件的M的同分异构体有6种(不考虑立体异构).
Ⅰ、含有间二取代苯环结构Ⅱ、属于酯Ⅲ、与FeCl3溶液发生显色反应.
写出其中不含甲基的一种同分异构体结构简式
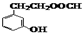 .
.
分析 根据题中各物质转化关系,ABCDE中碳原子数应相等,根据G的化学式可知,ABCDE中均含有3个碳原子,所以根据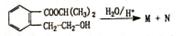 可得N为CH3CHOHCH3,M为
可得N为CH3CHOHCH3,M为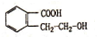 ,N在浓硫酸作用下得X为CH3CH=CH2,F的分子式为C9H12,F分子中核磁共振氢谱的峰面积之比为1:1:2:2:6,所以X与苯发生加成反应得F为
,N在浓硫酸作用下得X为CH3CH=CH2,F的分子式为C9H12,F分子中核磁共振氢谱的峰面积之比为1:1:2:2:6,所以X与苯发生加成反应得F为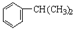 ,X与溴发生加成反应得A为CH3CHBrCH2Br,A发生碱性水解得B为CH3CHOHCH2OH,B发生氧化反应得C为CH3COCHO,C发生氧化反应得D为CH3COCOOH,D与氢气发生加成反就得E为CH3CHOHCOOH,E发生缩聚反应得G为
,X与溴发生加成反应得A为CH3CHBrCH2Br,A发生碱性水解得B为CH3CHOHCH2OH,B发生氧化反应得C为CH3COCHO,C发生氧化反应得D为CH3COCOOH,D与氢气发生加成反就得E为CH3CHOHCOOH,E发生缩聚反应得G为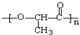 ,据此答题.
,据此答题.
解答 解:根据题中各物质转化关系,ABCDE中碳原子数应相等,根据G的化学式可知,ABCDE中均含有3个碳原子,所以根据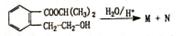 可得N为CH3CHOHCH3,M为
可得N为CH3CHOHCH3,M为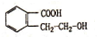 ,N在浓硫酸作用下得X为CH3CH=CH2,F的分子式为C9H12,F分子中核磁共振氢谱的峰面积之比为1:1:2:2:6,所以X与苯发生加成反应得F为
,N在浓硫酸作用下得X为CH3CH=CH2,F的分子式为C9H12,F分子中核磁共振氢谱的峰面积之比为1:1:2:2:6,所以X与苯发生加成反应得F为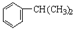 ,X与溴发生加成反应得A为CH3CHBrCH2Br,A发生碱性水解得B为CH3CHOHCH2OH,B发生氧化反应得C为CH3COCHO,C发生氧化反应得D为CH3COCOOH,D与氢气发生加成反就得E为CH3CHOHCOOH,E发生缩聚反应得G为
,X与溴发生加成反应得A为CH3CHBrCH2Br,A发生碱性水解得B为CH3CHOHCH2OH,B发生氧化反应得C为CH3COCHO,C发生氧化反应得D为CH3COCOOH,D与氢气发生加成反就得E为CH3CHOHCOOH,E发生缩聚反应得G为 ,
,
(1)E为CH3CHOHCOOH,E中所含两种官能团的名称是羟基和羧基,
故答案为:羟基、羧基;
(2)根据上面的分析可知,X→F是加成反应,F为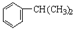 ,
,
故答案为:加成反应;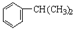 ;
;
(3)N转化为X的化学方程式为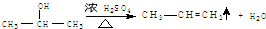 ,E转化为G的化学方程式为
,E转化为G的化学方程式为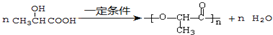 ,
,
故答案为: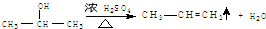 ;
;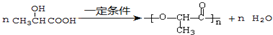 ;
;
(4)M为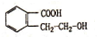 ,M中有苯环,能发生加成反应,有羟基和羧基,能发生缩聚反应和酯化反应,能与钠发生置换反应,羟基邻碳上有氢原子,能发生消去反应,没有酯基,不能发生水解反应,
,M中有苯环,能发生加成反应,有羟基和羧基,能发生缩聚反应和酯化反应,能与钠发生置换反应,羟基邻碳上有氢原子,能发生消去反应,没有酯基,不能发生水解反应,
故选e;
(5)M为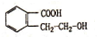 ,M的同分异构体,同时符合下列三个条件Ⅰ、含有间二取代苯环结构,Ⅱ、属于酯,Ⅲ、与FeCl3溶液发生显色反应,说明有酚羟基,这样的结构为在苯环的间位上分别连有-OH、-COOCH2CH3或-OH、-CH2COOCH3或-OH、HCOOCH2CH2-或-OH、HCOOCH(CH3)-或-OH、CH3COOCH2-或-OH、CH3CH2COO-,共有6种,其中不含甲基的一种同分异构体结构简式为
,M的同分异构体,同时符合下列三个条件Ⅰ、含有间二取代苯环结构,Ⅱ、属于酯,Ⅲ、与FeCl3溶液发生显色反应,说明有酚羟基,这样的结构为在苯环的间位上分别连有-OH、-COOCH2CH3或-OH、-CH2COOCH3或-OH、HCOOCH2CH2-或-OH、HCOOCH(CH3)-或-OH、CH3COOCH2-或-OH、CH3CH2COO-,共有6种,其中不含甲基的一种同分异构体结构简式为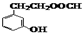 ,
,
故答案为:6; 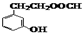 .
.
点评 本题考查有机物的合成,题目难度中等,注意根据有机物的官能团判断可能具有的性质,答题时注意把握题给信息,为解答该题的关键.

 名校课堂系列答案
名校课堂系列答案| A. | 电解熔融AlCl3 | B. | 加热CaCO3 | ||
| C. | 电解熔融NaCl | D. | 氯化钠与铝粉高温共热 |
| A. | 有机高分子化合物称为聚合物或高聚物,是因为它们大部分是由小分子通过聚合反应而制得的 | |
| B. |  的单体是HOCH2OH与 的单体是HOCH2OH与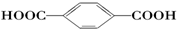 | |
| C. | 聚乙烯( )是由乙烯加聚生成的纯净物 )是由乙烯加聚生成的纯净物 | |
| D. | 高分子材料可分为天然高分子材料和合成高分子材料两大类 |
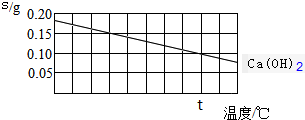
| A. | 氢氧化钙的溶解是吸热过程 | |
| B. | 温度升高时氢氧化钙溶解的速度减慢 | |
| C. | t℃时氢氧化钙的Ksp约等于2.46×10-4 | |
| D. | 向含有Ca(OH)2和Mg(OH)2两种沉淀的悬浊液中滴加NaOH浓溶液,分散系中$\frac{c(C{a}^{2+})}{c(M{g}^{2+})}$的比值不变 |
| A. | 等压时,通入惰性气体,c的物质的量不变 | |
| B. | 等压时,通入z气体反应器中温度升高 | |
| C. | 等容时,通入惰性气体,各反应速率不变 | |
| D. | 等容时,通入z气体,通入z气体的转化率较小 |
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 255 | 385 | 459 |
| 气体体积/mL | 280 | 336 | 336 |
(1)甲组实验中,盐酸(选填“过量”、“适量”或“不足量”,下同)过量;乙组实验中盐酸不足量.
(2)盐酸的物质的量浓度为1mol/L.
(3)合金中Mg、Al 的物质的量之比为1:1.
| A. | X单质不可以与CO2反应 | |
| B. | Y的氧化物是良好的半导体材料 | |
| C. | Z的氢化物比W的氢化物更稳定 | |
| D. | X的最高价氧化物和Z的最高价氧化物化合的产物中有共价键和离子键 |
 我国菱镁矿资源丰富、质地优良,是优势矿产之一,其主要成分是碳酸镁.某地菱镁矿中还含有较多的脉石(SiO2)和少量石灰石,利用该菱镁矿制备硫酸镁(MgSO4•7H2O),的实验步骤如下:
我国菱镁矿资源丰富、质地优良,是优势矿产之一,其主要成分是碳酸镁.某地菱镁矿中还含有较多的脉石(SiO2)和少量石灰石,利用该菱镁矿制备硫酸镁(MgSO4•7H2O),的实验步骤如下: