题目内容
1.科学家最近发现两种粒子;第一种是只由四个中子构成的粒子,这种粒子称为“四中子”也有人称之为“零号元素”.第二种是由四个氧原子构成的分子,下列有关这两种粒子的说法不正确的是( )| A. | 第二种粒子是氧元素的另一种核素 | |
| B. | “四中子”的质量数为4,其质量比氢原子大 | |
| C. | “四中子”不显电性 | |
| D. | 第二种粒子的化学式为O4,与O2互为同素异形体 |
分析 A.核素的分析对象是原子,O4是单质;
B.质量数=质子数+中子数;
C.中子不带电;
D.同种元素组成的不同单质互称同素异形体.
解答 解:A.同位素的分析对象是原子,O4是单质,故A错误;
B.因中子的质量数为1,则“四中子”的质量数为1×4=4,氢原子质量数是1,故B正确;
C.因中子不带电,则由四个中子构成的“四中子”粒子不带电,故C正确;
D.由四个氧原子构成的分子,其分子式为O4,与O2都是氧元素是不同单质,互为同素异形体,故D正确,
故选A.
点评 本题属于信息习题,考查了原子的构成微粒的性质及同位素、同素异形体等概念,难度不大,注重信息和所学知识的结合来解答.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.下列冶炼方法中,可将化合物中的金属元素还原为金属单质的是( )
| A. | 电解熔融AlCl3 | B. | 加热CaCO3 | ||
| C. | 电解熔融NaCl | D. | 氯化钠与铝粉高温共热 |
12.在标准状况下,取甲、乙、丙各30.0mL 相同浓度的盐酸,然后分别慢慢加入组成相同的镁铝合金粉末,得下表中有关数据(假设反应前后溶液体积不发生变化):
请回答:
(1)甲组实验中,盐酸(选填“过量”、“适量”或“不足量”,下同)过量;乙组实验中盐酸不足量.
(2)盐酸的物质的量浓度为1mol/L.
(3)合金中Mg、Al 的物质的量之比为1:1.
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 255 | 385 | 459 |
| 气体体积/mL | 280 | 336 | 336 |
(1)甲组实验中,盐酸(选填“过量”、“适量”或“不足量”,下同)过量;乙组实验中盐酸不足量.
(2)盐酸的物质的量浓度为1mol/L.
(3)合金中Mg、Al 的物质的量之比为1:1.
9.汽车的启动电源常用铅蓄电池,该电池在放电时的反应如下:Pb (s)+PbO2(s)+2H2SO4(aq)$?_{充电}^{放电}$2PbSO4(s)+2H2O(l),根据此反应判断下列叙述中正确的是( )
| A. | PbO2是电池的负极 | |
| B. | 负极的电极反应式为:Pb(s)+SO42-(aq)-2e -=PbSO4(s) | |
| C. | 铅蓄电池属于一次电池 | |
| D. | 电池放电时,溶液酸性增强 |
13.短周期元素X、Y、Z和W 的原子序数依次递增,且在同一周期,四种元素原子的最外层电子数之和为19,X和Y元素原子的原子序数比6:7,X的最高正价是W的最低负价的绝对值的2倍.下列说法正确的是( )
| A. | X单质不可以与CO2反应 | |
| B. | Y的氧化物是良好的半导体材料 | |
| C. | Z的氢化物比W的氢化物更稳定 | |
| D. | X的最高价氧化物和Z的最高价氧化物化合的产物中有共价键和离子键 |
10.如图为某燃煤电厂处理废气的装置示意图,下列说法错误的是( )
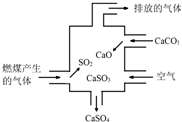

| A. | 使用此装置可以减少导致酸雨的气体的排放 | |
| B. | 该装置内既发生了化合反应,也发生了分解反应 | |
| C. | 总反应可表示为:2SO2+2CaCO3+O2→2CaSO4+2CO2 | |
| D. | 若排放的气体能使澄清石灰水变浑浊,说明该气体中含SO2 |
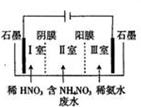 硝酸铵钙[5Ca(NO3)2•NH4NO3•10H2O]极易溶于水,是一种绿色复合肥料.
硝酸铵钙[5Ca(NO3)2•NH4NO3•10H2O]极易溶于水,是一种绿色复合肥料.