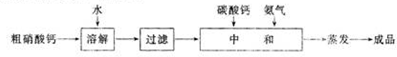
题目内容
2.常温下,下列溶液中微粒的物质的量的浓度关系正确的是( )| A. | 0.1mol•L-1的CH3COOH溶液中:c(CH3COO-)>c(H+)>c(OH-) | |
| B. | 0.1mol•L的NaHCO3溶液中:c(HCO3-)>c(CO32-)>c(H2CO3) | |
| C. | 0.1mol•L的NH4Cl溶液中:c(NH4+)+c(H+)=c(NH3•H2O)+c(OH-) | |
| D. | 0.1mol•L的(NH4)2SO4溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) |
分析 A.溶液中氢离子来自水的电离和醋酸的电离,则c(H+)>c(CH3COO-);
B.NaHC03溶液中HCO3-的水解程度大于电离程度,则:c(H2CO3)>c(CO32-);
C.根据氯化铵溶液中的电荷守恒分析;
D.铵根离子部分水解,溶液显示酸性,溶液中铵根离子的水解程度较小,则c(NH4+)>c(SO42-).
解答 解:A.醋酸溶液中,氢离子是水和醋酸的电离的,则c(H+)>c(CH3COO-),溶液中正确的离子浓度大小为:c(H+)>c(CH3COO-)>c(OH-),故A错误;
B.碳酸氢钠溶液中,碳酸氢根离子的电离程度小于水解程度,则c(H2CO3)>c(CO32-),正确的离子浓度大小为:c(HCO3-)>c(H2CO3)>c(CO32-),故B错误;
C.0.1mol•L的NH4Cl溶液中,根据电荷守恒可得:c(NH4+)+c(H+)=c(Cl-)+c(OH-),由于溶液中铵根离子的水解程度较小,则(Cl-)>c(NH3•H2O),故c(NH4+)+c(H+)>c(NH3•H2O)+c(OH-),故C错误;
D.0.1mol•L的(NH4)2SO4溶液中,铵根离子部分水解,溶液显示酸性,则:c(H+)>c(OH-),溶液中铵根离子的水解程度较小,则c(NH4+)>c(SO42-),溶液中离子浓度大小为:c(NH4+)>c(SO42-)>c(H+)>c(OH-),故D正确;
故选D.
点评 本题考查了离子浓度大小比较,题目难度中等,注意掌握电荷守恒、物料守恒及盐的水解原理的含义,明确判断离子浓度大小常用方法,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
12.在标准状况下,取甲、乙、丙各30.0mL 相同浓度的盐酸,然后分别慢慢加入组成相同的镁铝合金粉末,得下表中有关数据(假设反应前后溶液体积不发生变化):
请回答:
(1)甲组实验中,盐酸(选填“过量”、“适量”或“不足量”,下同)过量;乙组实验中盐酸不足量.
(2)盐酸的物质的量浓度为1mol/L.
(3)合金中Mg、Al 的物质的量之比为1:1.
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 255 | 385 | 459 |
| 气体体积/mL | 280 | 336 | 336 |
(1)甲组实验中,盐酸(选填“过量”、“适量”或“不足量”,下同)过量;乙组实验中盐酸不足量.
(2)盐酸的物质的量浓度为1mol/L.
(3)合金中Mg、Al 的物质的量之比为1:1.
13.短周期元素X、Y、Z和W 的原子序数依次递增,且在同一周期,四种元素原子的最外层电子数之和为19,X和Y元素原子的原子序数比6:7,X的最高正价是W的最低负价的绝对值的2倍.下列说法正确的是( )
| A. | X单质不可以与CO2反应 | |
| B. | Y的氧化物是良好的半导体材料 | |
| C. | Z的氢化物比W的氢化物更稳定 | |
| D. | X的最高价氧化物和Z的最高价氧化物化合的产物中有共价键和离子键 |
10.如图为某燃煤电厂处理废气的装置示意图,下列说法错误的是( )
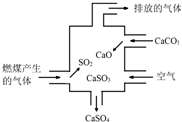

| A. | 使用此装置可以减少导致酸雨的气体的排放 | |
| B. | 该装置内既发生了化合反应,也发生了分解反应 | |
| C. | 总反应可表示为:2SO2+2CaCO3+O2→2CaSO4+2CO2 | |
| D. | 若排放的气体能使澄清石灰水变浑浊,说明该气体中含SO2 |
17.莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是( )
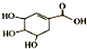

| A. | 分子式为C7H6O5 | B. | 可发生取代反应 | ||
| C. | 可使酸性高锰酸钾溶液褪色 | D. | 不能与溴水发生加成反应 |
12.25℃时,NH3•H2O和CH3COOH的电离常数K相等.下列说法正确的是( )
| A. | 常温下,CH3COONH4溶液的pH=7,与纯水中H2O的电离程度相同 | |
| B. | 向CH3COONH4溶液加入CH3COONa固体时,c(NH4+)、c(CH3COO-)均会增大 | |
| C. | 常温下,等浓度的NH4Cl和CH3COONa两溶液的pH之和为14 | |
| D. | 等温等浓度的氨水和醋酸两溶液加水稀释到相同体积,溶液pH的变化值一定相同 |
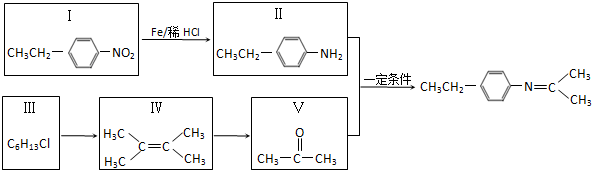
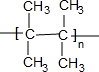 .
.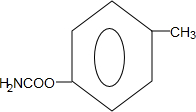 (写出一种).
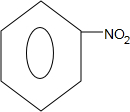
(写出一种).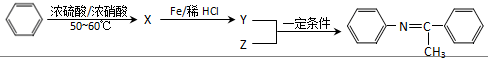
 ,Z的结构简式为
,Z的结构简式为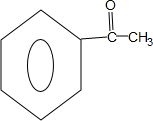 .
.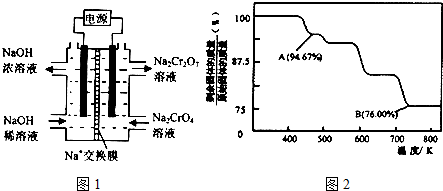
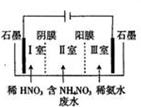 硝酸铵钙[5Ca(NO3)2•NH4NO3•10H2O]极易溶于水,是一种绿色复合肥料.
硝酸铵钙[5Ca(NO3)2•NH4NO3•10H2O]极易溶于水,是一种绿色复合肥料.