题目内容
2.参照反应Br+H?HBr+H的能量对反应历程的示意图,下列叙述中正确的是( )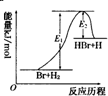
| A. | 该反应的反应热△H=E2-E1 | |
| B. | 加入催化剂,该化学反应的反应热和平衡常数变大 | |
| C. | 正反应的吸热反应 | |
| D. | 升高温度可增大正反应速率,降低逆反应速率 |
分析 A、根据化学反应焓变=反应物的总键能-生成物的总键能知识来回答;
B、催化剂不改变化学反应的始终态,也不影响平衡移动;
C、反应物总能量低于生成物总能量,则反应是吸热反应;
D、升高温度能使化学反应速率加快.
解答 解:A、该反应的△H=反应物的总键能-生成物的总键能,显然是一个正值,即△H=+(E1-E2)kJ/mol,故A错误;
B、催化剂只会改变反应速率,不会改变反应物和生成物,所以不会改变化学反应的反应热和平衡常数,故B错误;
C、当反应物总能量低于生成物总能量,则反应是吸热反应,根据图示可以看出:△H=+(E1-E2)kJ/mol>0,是吸热反应,故C正确;
D、升高温度能使化学反应速率加快,正反应速率加快,逆反应速率也加快,故D错误.
故选C.
点评 本题考查反应热,要掌握反应物的总能量小于生成物的总能量,反应吸热,反应物的总能量大于生成物的总能量,反应放热.

练习册系列答案
相关题目
12.下列叙述正确的是( )
| A. | 正戊烷分子中的最多有5个原子在同一平面上 | |
| B. | 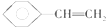 分子中最多有8个原子在同一平面上 分子中最多有8个原子在同一平面上 | |
| C. | CH2=CH-CH=CH2所有原子可能在同一直线上 | |
| D. | 2-丁烯(CH3CH=CHCH3)分子中4个碳原子可能在同一直线上 |
10.有机物分子中原子(或原子团)间的相互影响会导致化学性质的不同.下列叙述不能说明上述观点的是( )
| A. | 苯酚能与NaOH溶液反应,而乙醇不行 | |
| B. | 丙酮(CH3COCH3)分子中的氢比乙烷分子中的氢更易被卤原子取代 | |
| C. | 乙烯可发生加成反应,而乙烷不能 | |
| D. | 相等物质的量的甘油和乙醇分别与足量金属钠反应,甘油产生的H2多 |
7.不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组合是( )
| 序号 | 甲 | 乙 | 丙 |
| ① | CO2 | SO2 | 石灰水 |
| ② | HCl | CO2 | 石灰水 |
| ③ | CO2 | NH3 | Ca(Cl)2 |
| ④ | NO2 | SO2 | BaCl2 |
| ⑤ | CO2 | SO2 | Ba(NO3)2 |
| A. | ②④ | B. | ①②④⑤ | C. | ①③④⑤ | D. | ①②③④ |
11.下列冶炼方法中,可将化合物中的金属元素还原为金属单质的是( )
| A. | 电解熔融AlCl3 | B. | 加热CaCO3 | ||
| C. | 电解熔融NaCl | D. | 氯化钠与铝粉高温共热 |
12.在标准状况下,取甲、乙、丙各30.0mL 相同浓度的盐酸,然后分别慢慢加入组成相同的镁铝合金粉末,得下表中有关数据(假设反应前后溶液体积不发生变化):
请回答:
(1)甲组实验中,盐酸(选填“过量”、“适量”或“不足量”,下同)过量;乙组实验中盐酸不足量.
(2)盐酸的物质的量浓度为1mol/L.
(3)合金中Mg、Al 的物质的量之比为1:1.
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 255 | 385 | 459 |
| 气体体积/mL | 280 | 336 | 336 |
(1)甲组实验中,盐酸(选填“过量”、“适量”或“不足量”,下同)过量;乙组实验中盐酸不足量.
(2)盐酸的物质的量浓度为1mol/L.
(3)合金中Mg、Al 的物质的量之比为1:1.
 .
.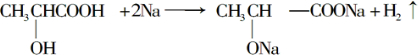 .
.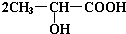 +Na2CO3→
+Na2CO3→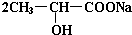 +H2O+CO2↑.
+H2O+CO2↑. .
. 我国菱镁矿资源丰富、质地优良,是优势矿产之一,其主要成分是碳酸镁.某地菱镁矿中还含有较多的脉石(SiO2)和少量石灰石,利用该菱镁矿制备硫酸镁(MgSO4•7H2O),的实验步骤如下:
我国菱镁矿资源丰富、质地优良,是优势矿产之一,其主要成分是碳酸镁.某地菱镁矿中还含有较多的脉石(SiO2)和少量石灰石,利用该菱镁矿制备硫酸镁(MgSO4•7H2O),的实验步骤如下: