题目内容
13. 将28.8g铜投入100ml浓硝酸中,最后铜剩余,其NO3-离子物质的量变化如图所示,请回答下列问题:
将28.8g铜投入100ml浓硝酸中,最后铜剩余,其NO3-离子物质的量变化如图所示,请回答下列问题:(1)开始反应时浓硝酸的物质的量浓度为10mol/L.
(2)铜与浓硝酸反应生成的气体在标准状况下的体积(不考虑NO2与N2O4的平衡)为8.96L.
(3)硝酸完全反应后消耗铜的物质的量是0.3mol.
(4)应再往此反应体系中滴加2mol/L的硫酸100ml,才能使剩余的铜恰好完全溶解.已知此过程中NO3-的还原产物为NO.
(5)在常温下,把NO气体压缩到1.01×107Pa,再加热到500℃,发现气体的压强迅速下降,压强降至略小于原压强的$\frac{2}{3}$,然后压强就不再改变.已知其中一种产物为N2O,则上述变化的化学方程式为3NO=N2O十NO2,2NO2?N2O4.
分析 (1)根据开始时硝酸根的物质的量计算硝酸的浓度;
(2)利用氮元素守恒计算气体的物质的量,再根据V=nVm计算二氧化氮的体积;
(3)反应结束,溶液中溶质为硝酸铜,根据硝酸根计算消耗n(Cu);
(4)发生反应:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,据此计算消耗硫酸的物质的量,进而计算需要硫酸的体积;
(5)由N元素的化合价变化及氧化还原反应以及二氧化氮与N2O4的化学平衡来分析.
解答 解:(1)由图可知,开始时n(NO3-)=1.0mol,则n(HNO3)=n(NO3-)=1.0mol,则c(HNO3)=$\frac{1.0mol}{0.1L}$=10mol/L,故答案为:10;
(2)由图可知,反应结束时,溶液中NO3-为0.6mol,根据氮元素守恒,生成气体的物质的量为1.0mol-0.6mol=0.4mol,标况下二氧化氮的体积为0.4mol×22.4L/mol=8.96L,故答案为:8.96;
(3)溶液中溶质为硝酸铜,由图可知,反应结束时,溶液中NO3-为0.6mol,故消耗n(Cu)=n(硝酸铜)=$\frac{0.6mol}{2}$=0.3mol,故答案为:0.3;
(4)28.8g铜的物质的量为$\frac{28.8g}{64g/mol}$=0.45mol,故剩余Cu为0.45mol-0.3mol=0.15mol,
3 Cu+2 NO3-+8 H+=3Cu2++2NO↑+4H2O
3 2 8
0.15mol n(H+)
则n(H+)=$\frac{0.15mol×8}{3}$=0.4mol,故n(H2SO4)=0.2mol,则需要硫酸体积为$\frac{0.2mol}{0.2mol/L}$=0.1L=100mL,
故答案为:100;
(5)由信息可知2NO→N2O,N的化合价降低2价,由氧化还原反应可知,则必有另一变化升高2价,依题意产物为NO2,该反应为3NO=N2O+NO2,此时压强降至原压强的$\frac{2}{3}$,如果压强降至略小于原压强的$\frac{2}{3}$,是因为存在转化:2NO2?N2O4.
故答案为:3NO=N2O+NO2;2NO2?N2O4.
点评 本题考查化学计算,属于拼合型题目,涉及守恒法、极限法的运用等,是对学生综合能力的考查,难度较大

| A. | 可用新制备的Cu(OH)2悬浊液将乙醇、乙酸、葡萄糖、蔗糖几种溶液区别开 | |
| B. | 乙烯与HCl、乙烷与Cl2这两组反应均可得到CH3CH2Cl,但二者反应类型不同 | |
| C. | 分子中有三个甲基且分子式C6H14的烃最多有三种 | |
| D. | 苯能发生加成反应、取代反应但不能发生氧化反应 |
| A. | 原子最外层电子数:X>Y>Z | B. | 对应气态氢化物的稳定性:X>Z | ||
| C. | 离子半径:X2->Y+>Z- | D. | 原子序数:X>Y>Z |
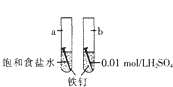
| A. | a是吸氧腐蚀,b是化学腐蚀 | |
| B. | a的负极反应时Fe-3e-═Fe3+ | |
| C. | a、b两处铁钉用导线联通有电流通过 | |
| D. | b前期发生析氢腐蚀,后期发生吸氧腐蚀 |
方案一 样品$\stackrel{CaCl_{2}}{→}$过滤$\stackrel{洗涤、干燥}{→}$称量
方案二 样品$\stackrel{BaCl_{2}}{→}$过滤$\stackrel{洗涤、干燥}{→}$称量
下列叙述正确的是( )
| A. | 方案一优于方案二,因为CaCl2比BaCl2更便宜 | |
| B. | 方案一优于方案二,因为其沉淀物溶解度更小沉淀更安全 | |
| C. | 用乙醇洗涤沉淀比用水洗涤,测量结果更准确 | |
| D. | 以上两种方案都必须采集样品的质量、沉淀剂和沉淀物的质量 |
| A. | 在溶剂中提高苯的比例,能提高溶液的导电性 | |
| B. | 电解时阳极的电极反应式为2Br--2e-=Br2 | |
| C. | 电解时可用铁作阳极材料 | |
| D. | 汽油样品应加在阴极区 |
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5.+3.-3 | -2 |
| A. | X.Y元素的金属性:X<Y | |
| B. | Z的最高价含氧酸分子式为H3ZO4 | |
| C. | Y的最高价氧化物对应的水化物能溶于氢氧化钠溶液 | |
| D. | Z的氢化物比W的氢化物稳定 |
| A. | 与K+距离相等且最近的O2-共有8个 | |
| B. | 与K+距离相等且最近的O2-构成的多面体是正八面体 | |
| C. | 与K+距离相等且最近的K+有8个 | |
| D. | 一个KO2晶胞中的K+和O2-粒子数均为8个 |