题目内容
4.X、Y、Z均是短周期元素,X、Y位于同一周期,X、Z的最低价离子分别为X2-和Z-,且Y+和Z-离子具有相同的电子层结构.下列说法正确的是( )| A. | 原子最外层电子数:X>Y>Z | B. | 对应气态氢化物的稳定性:X>Z | ||
| C. | 离子半径:X2->Y+>Z- | D. | 原子序数:X>Y>Z |
分析 X、Y、Z均是短周期元素,X、Z的最低价离子分别为X2-和Z-,则X为第ⅥA族元素,Z为ⅦA族元素;Y+和Z-具有相同的电子层结构,则Y在Z的下一周期,则Y为Na元素,Z为F元素,X、Y同周期,则X为S元素,结合元素在周期表中的位置以及元素周期律知识解答该题.
解答 解:X、Y、Z均是短周期元素,X、Z的最低价离子分别为X2-和Z-,则X为第ⅥA族元素,Z为ⅦA族元素;Y+和Z-具有相同的电子层结构,则Y在Z的下一周期,则Y为Na元素,Z为F元素,X、Y同周期,则X为S元素.
A.X、Y、Z分别为S、Na、F,原子最外层电子数分别为6、1、7,故A错误;
B.非金属性S<F,故氢化物稳定性H2S<HF,故B错误;
C.电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:S2->F->Na+,故C错误;
D.X、Y、Z原子序数分别为16、11、9,原子序数:X>Y>Z,故D正确,
故选D.
点评 本题考查原子结构与元素周期律的关系,侧重于学生的分析能力的考查,题目难度不大,关键是根据原子结构特点正确推断元素的种类.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.下列有关电能特点的说法错误的是( )
| A. | 电能是现代社会应用最广泛,使用最方便,污染最小的二次能源 | |
| B. | 目前我国发电总量中火电所占比率最多 | |
| C. | 燃煤发电过程中能量转换方式为:化学能→热能→机械能→电能 | |
| D. | 火力发电过程中能量转化率很高 |
15.化学反应中,有时存在“一种反应物过量,另一种反应物仍然不能完全反应”的特殊情况,下列反应中属于这种情况的是( )
①加热条件下,过量的Mg与浓硫酸充分反应
②4molH2与1molN2在一定条件下充分反应
③在加热条件下,过量的MnO2与浓盐酸充分反应
④在加热条件下,过量的Cu与浓硫酸充分反应
⑤过量的Ag与浓硝酸充分反应
⑥过量的稀硫酸与块状石灰石反应
⑦过量的Cl2与NaBr溶液反应.
①加热条件下,过量的Mg与浓硫酸充分反应
②4molH2与1molN2在一定条件下充分反应
③在加热条件下,过量的MnO2与浓盐酸充分反应
④在加热条件下,过量的Cu与浓硫酸充分反应
⑤过量的Ag与浓硝酸充分反应
⑥过量的稀硫酸与块状石灰石反应
⑦过量的Cl2与NaBr溶液反应.
| A. | ②③④⑥ | B. | ②③⑤⑦ | C. | ①③⑤⑥ | D. | ③④⑤⑥ |
19.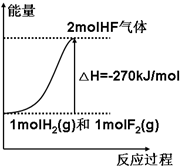 已知:H2(g)+F2(g)=2HF(g)△H=-270kJ/mol[表示1mol H2(g)与1mol F2(g)化合生成2mol HF(g)放出270kJ热量],下列说法正确的是( )
已知:H2(g)+F2(g)=2HF(g)△H=-270kJ/mol[表示1mol H2(g)与1mol F2(g)化合生成2mol HF(g)放出270kJ热量],下列说法正确的是( )
 已知:H2(g)+F2(g)=2HF(g)△H=-270kJ/mol[表示1mol H2(g)与1mol F2(g)化合生成2mol HF(g)放出270kJ热量],下列说法正确的是( )
已知:H2(g)+F2(g)=2HF(g)△H=-270kJ/mol[表示1mol H2(g)与1mol F2(g)化合生成2mol HF(g)放出270kJ热量],下列说法正确的是( )| A. | 该反应的逆反应是放热反应 | |
| B. | 该反应过程的能量变化可用右图来表示 | |
| C. | 1 mol H2(g)与1 mol F2(g)反应生成2 mol液态HF放出的热量小于270 kJ | |
| D. | 在相同条件下,1 mol H2(g)与1 mol F2(g)的能量总和大于2 mol HF(g)的能量 |
9.已知可逆反应2SO2+O2?2SO3,当生成2mol SO3时放出热量为Q,现将1mol SO2和0.5mol O2在相同条件下反应生成SO3放出的热量为Q1,则( )
| A. | 2Q1=Q | B. | 2Q1<Q | C. | 2Q1>Q | D. | 无法判断 |
16.某溶液仅含Fe2+、Na+、A13+、Ba2+、SO42-、NO3-、Cl-中的4种离子,所含离子的物质的量均为1mol.若向该溶液中加入少量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解).下列说法不正确的是( )
| A. | 若向该溶液中加人过量的稀硫酸和KSCN溶液,溶液显血红色 | |
| B. | 若向该溶液中加入过量的稀硫酸,产生的气体遇空气能变成红棕色 | |
| C. | 该溶液中所含的离子是Fe2+、Na+、SO42-、NO3- | |
| D. | 若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为72g |
5.正确掌握化学用语和化学基本概念是学好化学的基础.下列有关表述中正确的一组是( )
| A. | 16O与18O互为同位素;H2${\;}_{\;}^{16}$O、D2${\;}_{\;}^{16}$O、H2${\;}_{\;}^{18}$O、D2${\;}_{\;}^{18}$O互为同素异形体 | |
| B. | SiH4、PH3、HCl的稳定性逐渐增强 | |
| C. | 氧化铁的化学式:FeO | |
| D. | Ca2+的结构示意图为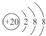 ,NH4Cl的电子式为 ,NH4Cl的电子式为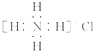 |
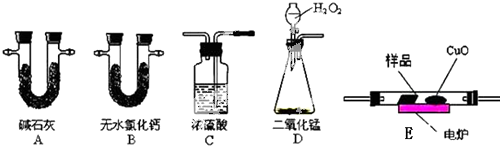
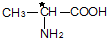 取4.4g样品(只含C、H、O三种元素中的两种或三种),经燃烧后A管增重8.8g,B管增重3.6g.请回答:
取4.4g样品(只含C、H、O三种元素中的两种或三种),经燃烧后A管增重8.8g,B管增重3.6g.请回答: 将28.8g铜投入100ml浓硝酸中,最后铜剩余,其NO3-离子物质的量变化如图所示,请回答下列问题:
将28.8g铜投入100ml浓硝酸中,最后铜剩余,其NO3-离子物质的量变化如图所示,请回答下列问题: