题目内容
14.KO2的晶体结构与NaCl相似,KO2可以看作是Na+的位置用K+代替,Cl-的位置用O2-代替,则下列对于KO2晶体结构的描述正确的是( )| A. | 与K+距离相等且最近的O2-共有8个 | |
| B. | 与K+距离相等且最近的O2-构成的多面体是正八面体 | |
| C. | 与K+距离相等且最近的K+有8个 | |
| D. | 一个KO2晶胞中的K+和O2-粒子数均为8个 |
分析 A、根据晶胞结构判断配位数;
B、根据两种离子所在位置,利用空间想象能力判断;
C、K+位于晶胞棱心,根据其位置判断距离相等且最近的K+数目;
D、利用均摊法计算.
解答 解:A、K+位于晶胞棱心,与K+距离相等且最近的O2-位于顶点和面心,共有6个,故A错误;
B、与K+距离相等且最近的O2-共有6个,构成正八面体,K+位于正八面体中心,故B正确;
C、K+位于晶胞棱心,则被横平面、竖平面和正平面共有,且每一个平面有4个K+距离最近,共4×3=12个,故C错误;
D、K+位于晶胞棱心和体心,数目为12×$\frac{1}{4}$+1=4,O2-位于顶点和面心,数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,即一个KO2晶胞中摊得的K+和O2-粒子数均为4个,故D错误;
故选B.
点评 本题考查晶胞计算和配位数,难度不大,要求学生有一定的空间想象能力.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
5.正确掌握化学用语和化学基本概念是学好化学的基础.下列有关表述中正确的一组是( )
| A. | 16O与18O互为同位素;H2${\;}_{\;}^{16}$O、D2${\;}_{\;}^{16}$O、H2${\;}_{\;}^{18}$O、D2${\;}_{\;}^{18}$O互为同素异形体 | |
| B. | SiH4、PH3、HCl的稳定性逐渐增强 | |
| C. | 氧化铁的化学式:FeO | |
| D. | Ca2+的结构示意图为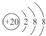 ,NH4Cl的电子式为 ,NH4Cl的电子式为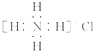 |
2.X、Y、Z、M、R、Q是短周期主族元素,部分信息如表所示:
(1)R在元素周期表中的位置是第三周期ⅦA族;
(2)Z的单质与水反应的化学方程式是2Na+2H2O=2NaOH+H2↑.
(3)Y与R相比,R非金属性较强,从原子结构角度解释原因:同周期自左而右,原子半径逐渐减小,得电子能力增强,非金属性增强,则非金属性Cl>Si;从实验事实角度解释,下列事实能证明这一结论的是bc(选填字母序号).
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性XR>YX4
c.Y与R形成的化合物中Y呈正价
d.将XR水溶液滴入Z2YM3溶液产生胶体
(4)根据表中数据推测,Y的原子半径的最小取值范围是大于0.099nm小于0.143nm.
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
| 其它 | 阳离子核外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
(2)Z的单质与水反应的化学方程式是2Na+2H2O=2NaOH+H2↑.
(3)Y与R相比,R非金属性较强,从原子结构角度解释原因:同周期自左而右,原子半径逐渐减小,得电子能力增强,非金属性增强,则非金属性Cl>Si;从实验事实角度解释,下列事实能证明这一结论的是bc(选填字母序号).
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性XR>YX4
c.Y与R形成的化合物中Y呈正价
d.将XR水溶液滴入Z2YM3溶液产生胶体
(4)根据表中数据推测,Y的原子半径的最小取值范围是大于0.099nm小于0.143nm.
6.如表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
(1)在这些元素中,化学性质最稳定的是Ar(填元素符号).最活泼的金属是K(填元素符号),离子结构示意图为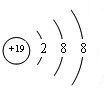 .元素⑩名称为溴,在周期表中的位置是第四周期ⅦA族.
.元素⑩名称为溴,在周期表中的位置是第四周期ⅦA族.
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4.
(3)这些元素中能形成两性氢氧化物的元素是铝(填名称),写出该元素的氢氧化物与④的最高价氧化物的水化物反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(4)元素①、②的最简单氢化物的稳定性:H2O大于NH3.(填写氢化物的分子式)
(5)请设计一个实验方案,比较⑥、⑦单质氧化性的强弱:在Na2S溶液中滴加Cl2水,若溶液出现浑浊,说明Cl2的氧化性比S强.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .元素⑩名称为溴,在周期表中的位置是第四周期ⅦA族.
.元素⑩名称为溴,在周期表中的位置是第四周期ⅦA族.(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4.
(3)这些元素中能形成两性氢氧化物的元素是铝(填名称),写出该元素的氢氧化物与④的最高价氧化物的水化物反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(4)元素①、②的最简单氢化物的稳定性:H2O大于NH3.(填写氢化物的分子式)
(5)请设计一个实验方案,比较⑥、⑦单质氧化性的强弱:在Na2S溶液中滴加Cl2水,若溶液出现浑浊,说明Cl2的氧化性比S强.
3.铅的冶炼大致过程如下:①富集:将方铅矿(PbS)进行浮选;②焙烧:2PbS+3O2$\frac{\underline{\;高温\;}}{\;}$2PbO+2SO2;③制粗铅:PbO+C$\frac{\underline{\;高温\;}}{\;}$Pb+CO;PbO+CO$\frac{\underline{\;高温\;}}{\;}$Pb+CO2.下列说法正确的是( )
| A. | 浮选法富集方铅矿的过程属于化学变化 | |
| B. | 方铅矿焙烧反应中,PbS是还原剂,还原产物只有PbO | |
| C. | 将1molPbS冶炼成Pb理论上至少需要6g碳 | |
| D. | 整个冶炼过程中,制取1molPb共转移2mol电子 |
4.下列说法中正确的是( )
| A. | 乙烯中碳碳双键的键能是乙烷中碳碳单键的键能的2倍 | |
| B. | NH4+中4个N-H键的键能不相同 | |
| C. | N-O键的极性比C-O键的极性小 | |
| D. | 球棍模型  表示二氧化碳分子,也可以表示二氧化氮分子 表示二氧化碳分子,也可以表示二氧化氮分子 |
 将28.8g铜投入100ml浓硝酸中,最后铜剩余,其NO3-离子物质的量变化如图所示,请回答下列问题:
将28.8g铜投入100ml浓硝酸中,最后铜剩余,其NO3-离子物质的量变化如图所示,请回答下列问题: