题目内容
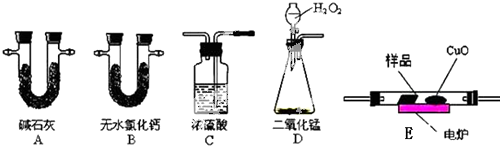
1.如图是研究铁钉腐蚀的装置图,下列说法正确的是( )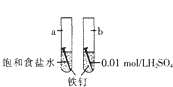
| A. | a是吸氧腐蚀,b是化学腐蚀 | |
| B. | a的负极反应时Fe-3e-═Fe3+ | |
| C. | a、b两处铁钉用导线联通有电流通过 | |
| D. | b前期发生析氢腐蚀,后期发生吸氧腐蚀 |
分析 A、a中电解质溶液显中性,为铁钉的吸氧腐蚀,b中电解质溶液为稀硫酸,显酸性为析氢腐蚀;
B、Fe失电子为原电池的负极;
C、原电池中要形成闭合回路才会出现电流;
D、根据电解质的环境确定金属发生腐蚀的类型.
解答 解:A、a中电解质溶液显中性,为铁钉的吸氧腐蚀,b中电解质溶液为稀硫酸,显酸性为析氢腐蚀;
B、a的负极反应时Fe-2e-═Fe2+,故B错误;
C、a、b两处铁钉用导线联通后,因为是断路所以没有电流产生,故C错误;
D、b中电解质溶液为稀硫酸,前期发生析氢腐蚀,随着氢离子的消耗,当溶液显示中性时,铁钉会发生吸氧腐蚀,故D正确.
故选D.
点评 本题考查了金属的腐蚀,试管内电解质溶液的酸碱性来确定铁发生腐蚀类型,再结合发生析氢腐蚀和吸氧腐蚀的原理来分析解答,题目难度不大.

练习册系列答案
相关题目
11.下列有机反应属于加成反应的是( )
| A. | CH2=CH-CH3+Cl2$\stackrel{高温}{→}$CH2=CHCH2Cl+HCl | |
| B. | 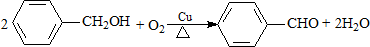 | |
| C. | 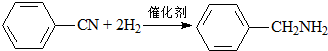 | |
| D. | 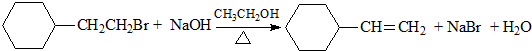 |
9.已知可逆反应2SO2+O2?2SO3,当生成2mol SO3时放出热量为Q,现将1mol SO2和0.5mol O2在相同条件下反应生成SO3放出的热量为Q1,则( )
| A. | 2Q1=Q | B. | 2Q1<Q | C. | 2Q1>Q | D. | 无法判断 |
16.某溶液仅含Fe2+、Na+、A13+、Ba2+、SO42-、NO3-、Cl-中的4种离子,所含离子的物质的量均为1mol.若向该溶液中加入少量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解).下列说法不正确的是( )
| A. | 若向该溶液中加人过量的稀硫酸和KSCN溶液,溶液显血红色 | |
| B. | 若向该溶液中加入过量的稀硫酸,产生的气体遇空气能变成红棕色 | |
| C. | 该溶液中所含的离子是Fe2+、Na+、SO42-、NO3- | |
| D. | 若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为72g |
6.甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.已知:CH3OH(l)+O2(g)=CO(g)+2H2O(g)△H1=-443.64kJ•mol-12CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ•mol-1下列说法或热化学方程式正确的是( )
| A. | CO的燃烧热为566.0 kJ•mol-1 | |
| B. | 2 mol CO和1 mol O2的总能量比2 mol CO2的总能量低 | |
| C. | 完全燃烧20g甲醇,生成二氧化碳和水蒸气时放出的热量为908.3 kJ | |
| D. | 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1453.28 kJ•mol-1 |
1.汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KN03→K20+5Na20+16N2↑.若氧化产物比还原产物多1.75mol,则下列判断正确的是( )
| A. | 生成40.0 L N2(标准状况) | |
| B. | 有0.250 mol KN03被氧化 | |
| C. | 转移电子的物质的量为1.25 mol | |
| D. | 被氧化的N原子的物质的量为2.5mol |
2.X、Y、Z、M、R、Q是短周期主族元素,部分信息如表所示:
(1)R在元素周期表中的位置是第三周期ⅦA族;
(2)Z的单质与水反应的化学方程式是2Na+2H2O=2NaOH+H2↑.
(3)Y与R相比,R非金属性较强,从原子结构角度解释原因:同周期自左而右,原子半径逐渐减小,得电子能力增强,非金属性增强,则非金属性Cl>Si;从实验事实角度解释,下列事实能证明这一结论的是bc(选填字母序号).
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性XR>YX4
c.Y与R形成的化合物中Y呈正价
d.将XR水溶液滴入Z2YM3溶液产生胶体
(4)根据表中数据推测,Y的原子半径的最小取值范围是大于0.099nm小于0.143nm.
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
| 其它 | 阳离子核外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
(2)Z的单质与水反应的化学方程式是2Na+2H2O=2NaOH+H2↑.
(3)Y与R相比,R非金属性较强,从原子结构角度解释原因:同周期自左而右,原子半径逐渐减小,得电子能力增强,非金属性增强,则非金属性Cl>Si;从实验事实角度解释,下列事实能证明这一结论的是bc(选填字母序号).
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性XR>YX4
c.Y与R形成的化合物中Y呈正价
d.将XR水溶液滴入Z2YM3溶液产生胶体
(4)根据表中数据推测,Y的原子半径的最小取值范围是大于0.099nm小于0.143nm.
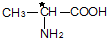 取4.4g样品(只含C、H、O三种元素中的两种或三种),经燃烧后A管增重8.8g,B管增重3.6g.请回答:
取4.4g样品(只含C、H、O三种元素中的两种或三种),经燃烧后A管增重8.8g,B管增重3.6g.请回答: 将28.8g铜投入100ml浓硝酸中,最后铜剩余,其NO3-离子物质的量变化如图所示,请回答下列问题:
将28.8g铜投入100ml浓硝酸中,最后铜剩余,其NO3-离子物质的量变化如图所示,请回答下列问题: