题目内容
13.现有①BaCl2 ②金刚石 ③碘片 ④冰 ⑤Na2SO4五种物质,按下列要求回答(填编号)(1)熔化时不需要破坏化学键的是③④,熔化时需要破坏共价键的是②,
(2)只有离子键的物质是①,含有共价键的离子化合物是⑤.
分析 先判断晶体类型,再判断化学键类型;
①BaCl2属离子晶体,只含离子键;
②金刚石属原子晶体,只含共价键;
③碘片属分子晶体,含共价键,分子间存在分子间作用力;
④冰属分子晶体,含共价键,分子间存在分子间作用力;
⑤Na2SO4属于离子晶体,存在离子键和共价键.
解答 解:①BaCl2属离子晶体,只含离子键;
②金刚石属原子晶体,只含共价键;
③碘片属分子晶体,含共价键,分子间存在分子间作用力;
④冰属分子晶体,含共价键,分子间存在分子间作用力;
⑤Na2SO4属于离子晶体,存在离子键和共价键.
(1)熔化时不需要破坏化学键的是分子晶体,熔化时需要破坏共价键的是原子晶体.
故答案为:③④; ②.
(2)只有离子键的物质是①,含有共价键的离子化合物是⑤;
故答案为:①; ⑤.
点评 本题考查的知识点较多,侧重考查学生对离子键、共价键,离子化合物、共价化合物的书写的辨别能力,题目难度不大.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
1.汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KN03→K20+5Na20+16N2↑.若氧化产物比还原产物多1.75mol,则下列判断正确的是( )
| A. | 生成40.0 L N2(标准状况) | |
| B. | 有0.250 mol KN03被氧化 | |
| C. | 转移电子的物质的量为1.25 mol | |
| D. | 被氧化的N原子的物质的量为2.5mol |
8.下列各组中互为同素异形体关系的是( )
| A. | H2与D2 | B. | T2O与H2O | ||
| C. | ${\;}_{19}^{40}$K与${\;}_{19}^{39}$K | D. | 金刚石与石墨 |
5.正确掌握化学用语和化学基本概念是学好化学的基础.下列有关表述中正确的一组是( )
| A. | 16O与18O互为同位素;H2${\;}_{\;}^{16}$O、D2${\;}_{\;}^{16}$O、H2${\;}_{\;}^{18}$O、D2${\;}_{\;}^{18}$O互为同素异形体 | |
| B. | SiH4、PH3、HCl的稳定性逐渐增强 | |
| C. | 氧化铁的化学式:FeO | |
| D. | Ca2+的结构示意图为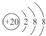 ,NH4Cl的电子式为 ,NH4Cl的电子式为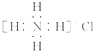 |
2.X、Y、Z、M、R、Q是短周期主族元素,部分信息如表所示:
(1)R在元素周期表中的位置是第三周期ⅦA族;
(2)Z的单质与水反应的化学方程式是2Na+2H2O=2NaOH+H2↑.
(3)Y与R相比,R非金属性较强,从原子结构角度解释原因:同周期自左而右,原子半径逐渐减小,得电子能力增强,非金属性增强,则非金属性Cl>Si;从实验事实角度解释,下列事实能证明这一结论的是bc(选填字母序号).
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性XR>YX4
c.Y与R形成的化合物中Y呈正价
d.将XR水溶液滴入Z2YM3溶液产生胶体
(4)根据表中数据推测,Y的原子半径的最小取值范围是大于0.099nm小于0.143nm.
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
| 其它 | 阳离子核外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
(2)Z的单质与水反应的化学方程式是2Na+2H2O=2NaOH+H2↑.
(3)Y与R相比,R非金属性较强,从原子结构角度解释原因:同周期自左而右,原子半径逐渐减小,得电子能力增强,非金属性增强,则非金属性Cl>Si;从实验事实角度解释,下列事实能证明这一结论的是bc(选填字母序号).
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性XR>YX4
c.Y与R形成的化合物中Y呈正价
d.将XR水溶液滴入Z2YM3溶液产生胶体
(4)根据表中数据推测,Y的原子半径的最小取值范围是大于0.099nm小于0.143nm.
3.铅的冶炼大致过程如下:①富集:将方铅矿(PbS)进行浮选;②焙烧:2PbS+3O2$\frac{\underline{\;高温\;}}{\;}$2PbO+2SO2;③制粗铅:PbO+C$\frac{\underline{\;高温\;}}{\;}$Pb+CO;PbO+CO$\frac{\underline{\;高温\;}}{\;}$Pb+CO2.下列说法正确的是( )
| A. | 浮选法富集方铅矿的过程属于化学变化 | |
| B. | 方铅矿焙烧反应中,PbS是还原剂,还原产物只有PbO | |
| C. | 将1molPbS冶炼成Pb理论上至少需要6g碳 | |
| D. | 整个冶炼过程中,制取1molPb共转移2mol电子 |
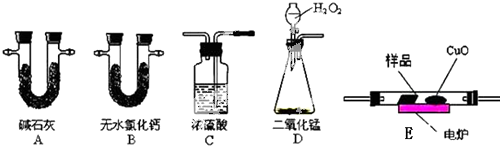
 取4.4g样品(只含C、H、O三种元素中的两种或三种),经燃烧后A管增重8.8g,B管增重3.6g.请回答:
取4.4g样品(只含C、H、O三种元素中的两种或三种),经燃烧后A管增重8.8g,B管增重3.6g.请回答: 将28.8g铜投入100ml浓硝酸中,最后铜剩余,其NO3-离子物质的量变化如图所示,请回答下列问题:
将28.8g铜投入100ml浓硝酸中,最后铜剩余,其NO3-离子物质的量变化如图所示,请回答下列问题: (1)实验室制备HCl气体的反应为:
(1)实验室制备HCl气体的反应为: