题目内容
9.下列叙述中能肯定说明金属A比金属B的失电子能力强的是( )| A. | A原子最外层电子数比B原子的最外层电子数少 | |
| B. | A原子电子层数比B原子的电子层数多 | |
| C. | 1molA从酸中置换生成的H2比1mol B从酸中置换生成的H2多 | |
| D. | A的最高价氧化物对应水化物是强碱,而B的最高价氧化物对应水化物是弱碱 |
分析 金属A比金属B的失电子能力强,说明A的金属性比B强,金属的金属性越强,金属最高价氧化物的水化物碱性越强,金属单质与酸或水越容易发生置换反应,较活泼金属能置换出较不活泼金属,据此判断金属性强弱.
解答 解:金属A比金属B的失电子能力强,说明A的金属性比B强,
A.A原子最外层电子数比B原子的最外层电子数少,不能说明A比B易失电子,如Ca的金属性大于Al,故A错误;
B.A原子电子层数比B原子的电子层数多,不能说明A比B易失电子,如Fe的金属性小于Na,故B错误;
C.金属性强弱与失电子多少无关,如相同物质的量的Al和Mg分别与足量稀盐酸反应,Al得到氢气质量大于镁,但金属性Al<Mg,故C错误;
D.金属的金属性越强,金属最高价氧化物的水化物碱性越强,A的最高价氧化物对应水化物是强碱,而B的最高价氧化物对应水化物是弱碱,说明金属性A>B,故D正确;
故选D.
点评 本题考查金属性强弱判断,为高频考点,注意金属性强弱要根据失电子难易程度判断,不能根据失电子多少判断,易错选项是C.

练习册系列答案
相关题目
19.将Al2(SO4)3和(NH4)2SO4的混合溶液a L分为两等份,其中一份加入bmol的BaCl2,恰好使溶液中的SO${\;}_{4}^{2-}$完全沉淀;另一份加入足量强碱并加热可得到cmolNH3,则原溶液中的Al3+的浓度(mol/L)为( )
| A. | $\frac{2b-c}{2a}$ | B. | $\frac{2b-c}{a}$ | C. | $\frac{2b-c}{3a}$ | D. | $\frac{4b-2c}{3a}$ |
20.常温下,下列盐溶液的pH>7的是( )
| A. | NaOH | B. | NaCl | C. | NH4Cl | D. | NaHC03 |
1.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 使石蕊变红色的溶液:Mg2+、K+、SO42-、NO3- | |
| B. | 使pH试纸呈深蓝色的溶液:Na+、Ba2+、HCO3-、NO3- | |
| C. | 0.1 mol•L-1AgNO3 溶液:H+、K+、SO42-、Br- | |
| D. | 0.1 mol•L-1 FeCl3溶液:H+、Na+、I-、SO42- |
18.下列叙述中,正确的是( )
| A. | 0.3 mol/L的Na2SO4溶液中含有Na+和SO42-的总物质的量为0.9 mol | |
| B. | 当1 L水吸收标准状况下的22.4 L氯化氢时所得盐酸的浓度是1 mol/L | |
| C. | 在K2SO4和NaCl的中性混合水溶液中,如果Na+和SO42-的物质的量相等,则K+和Cl-的物质的量浓度一定相同 | |
| D. | 10℃时,0.35 mol/L的KCl饱和溶液100 mL蒸发掉5 g水,恢复到10℃时,它的物质的量浓度仍为0.35 mol/L |

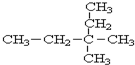 3,3-二甲基戊烷.
3,3-二甲基戊烷. .再将反应后的混合物转移到分液漏斗中,振荡、静置,然后分液.从分液漏斗放出下层液体,加入适量盐酸,再将其分成两份:向一份溶液中加入三氯化铁溶液,出现的现象是溶液呈紫色;向另一份溶液中加入浓溴水,反应的化学方程式为
.再将反应后的混合物转移到分液漏斗中,振荡、静置,然后分液.从分液漏斗放出下层液体,加入适量盐酸,再将其分成两份:向一份溶液中加入三氯化铁溶液,出现的现象是溶液呈紫色;向另一份溶液中加入浓溴水,反应的化学方程式为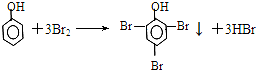 .从分液漏斗上口倒出的液体是苯.
.从分液漏斗上口倒出的液体是苯.