题目内容
18.下列叙述中,正确的是( )| A. | 0.3 mol/L的Na2SO4溶液中含有Na+和SO42-的总物质的量为0.9 mol | |
| B. | 当1 L水吸收标准状况下的22.4 L氯化氢时所得盐酸的浓度是1 mol/L | |
| C. | 在K2SO4和NaCl的中性混合水溶液中,如果Na+和SO42-的物质的量相等,则K+和Cl-的物质的量浓度一定相同 | |
| D. | 10℃时,0.35 mol/L的KCl饱和溶液100 mL蒸发掉5 g水,恢复到10℃时,它的物质的量浓度仍为0.35 mol/L |
分析 A.溶液体积未知,不能计算离子具体物质的量;
B.应该是溶液的体积为1L,不是溶剂水的体积为1L;
C.根据溶液呈电中性,则c(Na+)+c(K+)=2c(SO42-)+c(Cl-),据此判断;
D.10℃时,0.35 mol/L的KCl饱和溶液100 mL蒸发掉5 g水,恢复到10℃时,剩余溶液仍然为饱和溶液.
解答 解:A.溶液体积未知,不能计算离子具体物质的量,故A错误;
B.标况下22.4L HCl为1mol,溶于水配成1L溶液,所得溶液浓度为1mol/L,不是溶剂水的体积为1L,故B错误;
C.根据溶液呈电中性,则c(Na+)+c(K+)=2c(SO42-)+c(Cl-),如果Na+和SO42-的物质的量相等,则c(K+)=c(SO42-)+c(Cl-),K+和Cl-的物质的量浓度一定不相同,故C错误;
D.10℃时,0.35 mol/L的KCl饱和溶液100 mL蒸发掉5 g水,恢复到10℃时,剩余溶液仍然为饱和溶液,它的物质的量浓度仍为0.35 mol/L,故D正确,
故选D.
点评 本题考查物质的量浓度及有关计算,难度不大,注意对定义式的理解,C选项注意根据电荷守恒解答.

练习册系列答案
相关题目
8.如图为某原电池装置的示意图.下列叙述中,正确的是( )
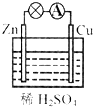

| A. | 负极发生的反应是Zn-2e-═Zn2+ | B. | 正极发生的是氧化反应 | ||
| C. | 一段时间后,溶液的pH减小 | D. | 一段时间后,铜片的质量增加 |
9.下列叙述中能肯定说明金属A比金属B的失电子能力强的是( )
| A. | A原子最外层电子数比B原子的最外层电子数少 | |
| B. | A原子电子层数比B原子的电子层数多 | |
| C. | 1molA从酸中置换生成的H2比1mol B从酸中置换生成的H2多 | |
| D. | A的最高价氧化物对应水化物是强碱,而B的最高价氧化物对应水化物是弱碱 |
6.北京大学和中国科学院的化学工作者合作已成功研制出碱金属与C60形成的球碳盐K3C60实验测知该物质属于离子化合物,且有良好的超导性,下列关于K3C60的组成和结构的分析正确的是( )
| A. | K3C60中既有离子键,又有极性共价键 | |
| B. | 该物质在熔融状态下能导电 | |
| C. | 该物质的化学式可写成KC20 | |
| D. | 1molK3C60中含有的共价键的数目约为60×6.02×1023个 |
3.下列烷烃的系统命名中,不正确的是( )
| A. | 2,3-二甲基戊烷 | B. | 2,2,3-三甲基丁烷 | ||
| C. | 3,3-二甲基丁烷 | D. | 3-甲基-2-乙基戊烷 |
10.38.4g铜与适量浓硝酸反应,铜全部作用后共收集到标况下气体22.4L,则反应消耗HNO3的物质的量为( )
| A. | 1mol | B. | 1.6mol | C. | 2.2mol | D. | 2.4mol |
7.质量相同的N2O4和NO2中,下列说法正确的是( )
| A. | 氮元素的质量比是1:2 | B. | 氮元素的物质的量之比是1:1 | ||
| C. | N2O4和NO2的分子数之比是1:1 | D. | 氧原子个数之比是2:1 |