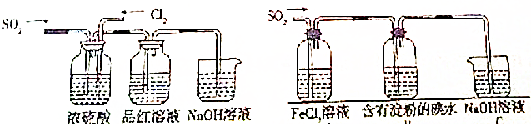
题目内容
1.常温下,下列各组离子在指定溶液中一定能大量共存的是( )| A. | 使石蕊变红色的溶液:Mg2+、K+、SO42-、NO3- | |
| B. | 使pH试纸呈深蓝色的溶液:Na+、Ba2+、HCO3-、NO3- | |
| C. | 0.1 mol•L-1AgNO3 溶液:H+、K+、SO42-、Br- | |
| D. | 0.1 mol•L-1 FeCl3溶液:H+、Na+、I-、SO42- |
分析 A.使石蕊变红色的溶液呈酸性;
B.使pH试纸呈深蓝色的溶液呈碱性;
C.能和银离子反应的离子不能大量共存;
D.氯化铁具有氧化性,能和铁离子反应的离子不能大量共存.
解答 解:A.使石蕊变红色的溶液呈酸性,这几种离子之间不反应,且和氢离子不反应,所以能大量共存,故A正确;
B.使pH试纸呈深蓝色的溶液呈碱性,Ba2+、HCO3-、OH-反应生成碳酸钡沉淀,所以不能大量共存,故B错误;
C.能和银离子反应的离子不能大量共存,Ag+和SO42-、Br-生成沉淀而不能大量共存,故C错误;
D.氯化铁具有氧化性,能和铁离子反应的离子不能大量共存,碘离子和铁离子发生氧化还原反应生成亚铁离子和碘而不能大量共存,故D错误;
故选A.
点评 本题考查离子共存,明确离子性质及离子共存条件是解本题关键,侧重考查复分解反应和氧化还原反应,易错选项是D.

练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案
相关题目
11.下列有关物质水解的说法中,正确的是( )
| A. | 蔗糖水解产物仅有葡萄糖 | |
| B. | 淀粉、纤维素最终水解产物均为单糖 | |
| C. | 酯在强碱作用下水解生成对应的酸和醇 | |
| D. | 溴乙烷在NaOH的醇溶液中水解生成乙烯 |
12.铝元素对人体健康有危害.因此,1989年世界卫生组织正式把铝确定为食品污染源之一而须加以控制.铝在下列应用场合使用时应加以控制的是( )
①制铝合金 ②制电线 ③制炊具 ④制银色漆颜料 ⑤用明矾净水 ⑥明矾和小苏打制食品膨松剂 ⑦制易拉罐 ⑧用氢氧化铝凝胶制胃舒平 ⑨包装糖果盒小食品.
①制铝合金 ②制电线 ③制炊具 ④制银色漆颜料 ⑤用明矾净水 ⑥明矾和小苏打制食品膨松剂 ⑦制易拉罐 ⑧用氢氧化铝凝胶制胃舒平 ⑨包装糖果盒小食品.
| A. | ③⑤⑧⑨ | B. | ⑥⑧⑨ | C. | ③⑤⑨ | D. | ③⑤⑥⑦⑧⑨ |
9.下列叙述中能肯定说明金属A比金属B的失电子能力强的是( )
| A. | A原子最外层电子数比B原子的最外层电子数少 | |
| B. | A原子电子层数比B原子的电子层数多 | |
| C. | 1molA从酸中置换生成的H2比1mol B从酸中置换生成的H2多 | |
| D. | A的最高价氧化物对应水化物是强碱,而B的最高价氧化物对应水化物是弱碱 |
16.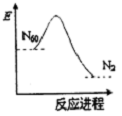 最近科学家确认,存在着一种具有空心,且类似于足球结构的分子N60,N60转化N2的能量变化如图所示.下列说法正确的是( )
最近科学家确认,存在着一种具有空心,且类似于足球结构的分子N60,N60转化N2的能量变化如图所示.下列说法正确的是( )
 最近科学家确认,存在着一种具有空心,且类似于足球结构的分子N60,N60转化N2的能量变化如图所示.下列说法正确的是( )
最近科学家确认,存在着一种具有空心,且类似于足球结构的分子N60,N60转化N2的能量变化如图所示.下列说法正确的是( )| A. | N60转化N2是物理变化 | B. | N2不如N60稳定 | ||
| C. | N60转化N2是吸收能量的过程 | D. | N60可能成为一种好的火箭材料 |
6.北京大学和中国科学院的化学工作者合作已成功研制出碱金属与C60形成的球碳盐K3C60实验测知该物质属于离子化合物,且有良好的超导性,下列关于K3C60的组成和结构的分析正确的是( )
| A. | K3C60中既有离子键,又有极性共价键 | |
| B. | 该物质在熔融状态下能导电 | |
| C. | 该物质的化学式可写成KC20 | |
| D. | 1molK3C60中含有的共价键的数目约为60×6.02×1023个 |
10.38.4g铜与适量浓硝酸反应,铜全部作用后共收集到标况下气体22.4L,则反应消耗HNO3的物质的量为( )
| A. | 1mol | B. | 1.6mol | C. | 2.2mol | D. | 2.4mol |
11. 近年来全国各地长期被雾霾笼罩,雾霾颗粒中汽车尾气占20%以上.已知汽车尾气中的主要污染物为NOx、CO、燃烧源超细颗粒(PM2.5)等由害物质.目前,已研究出了多种消除汽车尾气污染的方法.
近年来全国各地长期被雾霾笼罩,雾霾颗粒中汽车尾气占20%以上.已知汽车尾气中的主要污染物为NOx、CO、燃烧源超细颗粒(PM2.5)等由害物质.目前,已研究出了多种消除汽车尾气污染的方法.
(1)催化剂存在时用H2将NO还原为N2.
已知:
则H2还原NO生成氮气和水蒸气的热化学方程式是:2NO(g)+2H2(g)═N2(g)+2H2O(g)△H=-665 kJ•mol-1.
(2)用活性炭还原处理氮氧化物,有关反应为
C(s)+2NO(g)?N2(g)+CO2(g)△H
在2L恒容密闭器中加入足量的C与NO反应,所得实验数据如表
①写出该反应的平衡常数表达式$\frac{c({N}_{2})c(C{O}_{2})}{{c}^{2}(NO)}$.
②结合表中数据,判断该反应的△H>0(填“>”或“<”),理由是计算700°C和800°C的平衡常数K1<K2,所以△H>0.
③实验3达到平衡时,NO的转化率为67%.(保留2位有效数字)
④根据实验2数据,假设反应在t1时刻达到平衡,若t2时刻保持温度不变,将容器体积压缩至原来一半,请在图中作出整个过程中CO2的体积分数(CO2)随时间变化的曲线.
 近年来全国各地长期被雾霾笼罩,雾霾颗粒中汽车尾气占20%以上.已知汽车尾气中的主要污染物为NOx、CO、燃烧源超细颗粒(PM2.5)等由害物质.目前,已研究出了多种消除汽车尾气污染的方法.
近年来全国各地长期被雾霾笼罩,雾霾颗粒中汽车尾气占20%以上.已知汽车尾气中的主要污染物为NOx、CO、燃烧源超细颗粒(PM2.5)等由害物质.目前,已研究出了多种消除汽车尾气污染的方法.(1)催化剂存在时用H2将NO还原为N2.
已知:

则H2还原NO生成氮气和水蒸气的热化学方程式是:2NO(g)+2H2(g)═N2(g)+2H2O(g)△H=-665 kJ•mol-1.
(2)用活性炭还原处理氮氧化物,有关反应为
C(s)+2NO(g)?N2(g)+CO2(g)△H
在2L恒容密闭器中加入足量的C与NO反应,所得实验数据如表
| 实验编号 | 温度/°C | 起始时NO的物质的量/mol | 平衡时N2的物质的量/mol |
| 1 | 700 | 0.40 | 0.09 |
| 2 | 800 | 0.24 | 0.08 |
| 3 | 800 | 0.20 | a |
②结合表中数据,判断该反应的△H>0(填“>”或“<”),理由是计算700°C和800°C的平衡常数K1<K2,所以△H>0.
③实验3达到平衡时,NO的转化率为67%.(保留2位有效数字)
④根据实验2数据,假设反应在t1时刻达到平衡,若t2时刻保持温度不变,将容器体积压缩至原来一半,请在图中作出整个过程中CO2的体积分数(CO2)随时间变化的曲线.