题目内容
19.将Al2(SO4)3和(NH4)2SO4的混合溶液a L分为两等份,其中一份加入bmol的BaCl2,恰好使溶液中的SO${\;}_{4}^{2-}$完全沉淀;另一份加入足量强碱并加热可得到cmolNH3,则原溶液中的Al3+的浓度(mol/L)为( )| A. | $\frac{2b-c}{2a}$ | B. | $\frac{2b-c}{a}$ | C. | $\frac{2b-c}{3a}$ | D. | $\frac{4b-2c}{3a}$ |
分析 根据SO42-+Ba2+═BaSO4↓计算溶液中的SO42-离子的物质的量,根据NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O计算NH4+的物质的量,再根据c=$\frac{n}{V}$计算SO42-离子、NH4+离子浓度,再利用电荷守恒有3n(Al3+)+c(NH4+)=2c(SO42-),据此计算原溶液中的Al3+浓度.
解答 解:将Al2(SO4)3和(NH4)2SO4的混合溶液a L分为两等份,每份的体积为0.5a,
向0.5aL混合溶液中加入bmolBaCl2,恰好使溶液中的SO42-离子完全沉淀,则:
SO42-+Ba2+═BaSO4↓
bmol bmol
c(SO42-)=$\frac{bmol}{0.5aL}$=$\frac{2b}{a}$mol/L,
向0.5aL混合溶液中加入足量强碱并加热可得到cmolNH3,则:
NH4++OH- $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O
cmol cmol
c(NH4+)=$\frac{cmol}{0.5aL}$=$\frac{2c}{a}$mol/L,
又溶液不显电性,设原溶液中的Al3+浓度为x,由电荷守恒可知,
x×3+$\frac{2c}{a}$mol/L×1=$\frac{2b}{a}$mol/L×2,
解得x=$\frac{4b-2c}{3a}$mol/L,
故选D.
点评 本题考查混合物的有关计算、物质的量浓度的计算等,题目难度中等,明确发生的离子反应及溶液不显电性是解答本题的关键,注意熟悉物质的量浓度的计算公式.

练习册系列答案
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
9.下列各组物质不能实现直接转化的是( )
| A. | SO2→H2SO4 | B. | Cu→CuCl2 | C. | Al2O3→Al(OH)3 | D. | Na→Na2O |
10.下列有关烃的衍生物说法中,正确的是( )
| A. | 用钠检验乙醇中含有少量水 | |
| B. | 能与新制氢氧化铜反应的物质一定是乙醛 | |
| C. | 乙酸与乙酸乙酯互为同分异构体 | |
| D. | 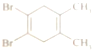 如图所示有机物分子核磁共振氢谱有两个峰 |
7.下列关于有机物的说法中,错误的是( )
| A. | 在一定条件下葡萄糖能与新制Cu(OH)2发生反应 | |
| B. | 肥皂的主要成分是油脂在碱性条件下水解生成的 | |
| C. | 淀粉、纤维素和油脂都是天然高分子化合物 | |
| D. | 蛋白质溶液遇硫酸铜后产生的沉淀不能重新溶于水 |
14.某元素的天然同位素有${\;}_{5}^{10}$X和${\;}_{5}^{11}$X两种,如果该元素的相对原子质量为10.8,那么元素X的天然同位素中${\;}_{5}^{10}$X和
${\;}_{5}^{11}$X的原子个数之比为( )
${\;}_{5}^{11}$X的原子个数之比为( )
| A. | 3:1 | B. | 1:3 | C. | 4:1 | D. | 1:4 |
4.下列事实可以表明醋酸是弱电解质的是( )
| A. | 醋酸能与水任意比例互溶 | |
| B. | 醋酸溶液的导电能力比盐酸弱 | |
| C. | 醋酸溶液中存在醋酸根离子、氢离子 | |
| D. | 常温下,1 mol•L-1的醋酸中c(H+)约为0.01 mol•L-1 |
11.下列有关物质水解的说法中,正确的是( )
| A. | 蔗糖水解产物仅有葡萄糖 | |
| B. | 淀粉、纤维素最终水解产物均为单糖 | |
| C. | 酯在强碱作用下水解生成对应的酸和醇 | |
| D. | 溴乙烷在NaOH的醇溶液中水解生成乙烯 |
8.如图为某原电池装置的示意图.下列叙述中,正确的是( )
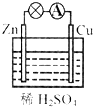

| A. | 负极发生的反应是Zn-2e-═Zn2+ | B. | 正极发生的是氧化反应 | ||
| C. | 一段时间后,溶液的pH减小 | D. | 一段时间后,铜片的质量增加 |
9.下列叙述中能肯定说明金属A比金属B的失电子能力强的是( )
| A. | A原子最外层电子数比B原子的最外层电子数少 | |
| B. | A原子电子层数比B原子的电子层数多 | |
| C. | 1molA从酸中置换生成的H2比1mol B从酸中置换生成的H2多 | |
| D. | A的最高价氧化物对应水化物是强碱,而B的最高价氧化物对应水化物是弱碱 |