题目内容
20.常温下,下列盐溶液的pH>7的是( )| A. | NaOH | B. | NaCl | C. | NH4Cl | D. | NaHC03 |
分析 常温下,盐溶液的pH>7,则该溶液呈碱性,说明该盐是强碱弱酸盐,弱酸根离子水解导致溶液呈碱性,据此分析解答.
解答 解:A.氢氧化钠是强碱,不是盐,故A错误;
B.NaCl是强碱强酸盐,不水解,所以溶液呈中性,常温下pH=7,故B错误;
C.氯化铵是强酸弱碱盐,铵根离子水解导致溶液呈酸性,常温下水溶液pH<7,故C错误;
D.碳酸氢钠是强碱弱酸酸式盐,碳酸氢根离子水解程度大于电离程度而导致溶液呈碱性,常温下水溶液pH>7,故D正确;
故选D.
点评 本题考查盐类水解及溶液酸碱性判断,明确盐的特点是解本题关键,注意:有些酸式盐水溶液呈酸性,如硫酸氢钠、亚硫酸氢钠等,易错选项是A,虽然氢氧化钠溶液呈碱性但NaOH是碱,注意题干中限制性条件“盐溶液”,为易错点.

练习册系列答案
相关题目
10.下列有关烃的衍生物说法中,正确的是( )
| A. | 用钠检验乙醇中含有少量水 | |
| B. | 能与新制氢氧化铜反应的物质一定是乙醛 | |
| C. | 乙酸与乙酸乙酯互为同分异构体 | |
| D. | 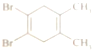 如图所示有机物分子核磁共振氢谱有两个峰 |
11.下列有关物质水解的说法中,正确的是( )
| A. | 蔗糖水解产物仅有葡萄糖 | |
| B. | 淀粉、纤维素最终水解产物均为单糖 | |
| C. | 酯在强碱作用下水解生成对应的酸和醇 | |
| D. | 溴乙烷在NaOH的醇溶液中水解生成乙烯 |
8.如图为某原电池装置的示意图.下列叙述中,正确的是( )
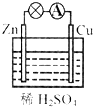

| A. | 负极发生的反应是Zn-2e-═Zn2+ | B. | 正极发生的是氧化反应 | ||
| C. | 一段时间后,溶液的pH减小 | D. | 一段时间后,铜片的质量增加 |
5.以下有关元素性质的说法不正确的是( )
| A. | 具有下列电子式的原子中,①1s22s22p63s23p2、②1s22s22p3、③1s22s22p2、④1s22s22p63s23p4,原子半径最大的是① | |
| B. | 下列原子的价电子排布中,①3s23p1②3s23p2③3s23p3④3s23p4对应的第一电离能最大是③ | |
| C. | 某元素的逐级电离能分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X3+ | |
| D. | ①Na、K、Rb,②N、P、As,③O、S、Se,④Na、P、Cl 元素的电负性随原子序数增大而递增的是④ |
12.铝元素对人体健康有危害.因此,1989年世界卫生组织正式把铝确定为食品污染源之一而须加以控制.铝在下列应用场合使用时应加以控制的是( )
①制铝合金 ②制电线 ③制炊具 ④制银色漆颜料 ⑤用明矾净水 ⑥明矾和小苏打制食品膨松剂 ⑦制易拉罐 ⑧用氢氧化铝凝胶制胃舒平 ⑨包装糖果盒小食品.
①制铝合金 ②制电线 ③制炊具 ④制银色漆颜料 ⑤用明矾净水 ⑥明矾和小苏打制食品膨松剂 ⑦制易拉罐 ⑧用氢氧化铝凝胶制胃舒平 ⑨包装糖果盒小食品.
| A. | ③⑤⑧⑨ | B. | ⑥⑧⑨ | C. | ③⑤⑨ | D. | ③⑤⑥⑦⑧⑨ |
9.下列叙述中能肯定说明金属A比金属B的失电子能力强的是( )
| A. | A原子最外层电子数比B原子的最外层电子数少 | |
| B. | A原子电子层数比B原子的电子层数多 | |
| C. | 1molA从酸中置换生成的H2比1mol B从酸中置换生成的H2多 | |
| D. | A的最高价氧化物对应水化物是强碱,而B的最高价氧化物对应水化物是弱碱 |
10.38.4g铜与适量浓硝酸反应,铜全部作用后共收集到标况下气体22.4L,则反应消耗HNO3的物质的量为( )
| A. | 1mol | B. | 1.6mol | C. | 2.2mol | D. | 2.4mol |