题目内容
【题目】次氯酸及其盐溶液有杀菌、消毒、漂白的作用。在此次抗击新冠疫情中发挥了巨大作用。某学习小组根据需要欲制备浓度不小于0.8mol·L-1的次氯酸溶液。
(查阅资料)
资料1:常温常压下,Cl2O是黄棕色具有强烈刺激性气味的气体,是一种强氧化剂,易溶于水,且会与水反应生成次氯酸。
资料2:Cl2O的沸点为3.8℃,42℃以上会分解生成Cl2和O2;Cl2的沸点为-34.6℃
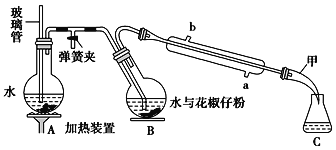
该小组用Cl2与潮湿的碳酸钠制取Cl2O,并进一步制取次氯酸,装置如下。
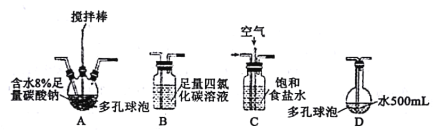
回答下列问题:
(1)装置连接顺序为Cl2→___。(用字母表示)
(2)装置A中反应的化学方程式是___。
(3)装置B的作用___,整个实验加快反应速率所采用的方法有___。
(4)装置D中反应的化学方程式是___。
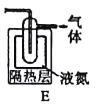
(5)如果要收集Cl2O,则可以在B装置后连接E装置进行收集,这样做的依据是什么___,逸出气体的主要成分是___。
(6)此方法相对于用氯气直接溶于水制备次氯酸溶液的优点是___(答出一条即可)。
(7)测定反应完成后A中物质的质量分数:取mg样品加适量蒸馏水使之溶解,加入几滴酚酞,用0.1molL-1的盐酸标准溶液滴定至溶液由红色变为无色,消耗盐酸V1mL;再向已变无色的溶液中加入几滴甲基橙,继续用该盐酸滴定至溶液由黄色变橙色,又消耗盐酸V2mL。
①则由上述实验可测定反应完成后A中物质的质量分数为___(说明具体物质并用含m、V1和V2的代数式表示)。
②若用甲基橙作指示剂滴定结束时,滴定管尖嘴有气泡,对测定结果的影响是___。
【答案】CABD 2Cl2+2Na2CO3+H2O=Cl2O+2NaCl+2NaHCO3 除去Cl2O中混有的Cl2 搅拌棒和使用多空球泡装置 Cl2O+H2O=2HClO E中液氨作制冷剂,使Cl2O冷凝成液态 空气 制得的次氯酸溶液浓度较大或制得的次氯酸溶液纯度较高或制得的次氯酸溶液不含有Cl-离子或氯元素的利用率高等 Na2CO3:![]() ×100%;NaHCO3:
×100%;NaHCO3:![]() ×100% Na2CO3:不变;NaHCO3:偏低
×100% Na2CO3:不变;NaHCO3:偏低
【解析】
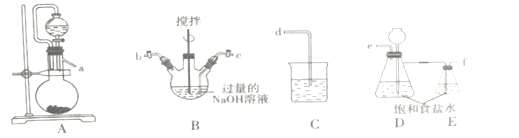
实验室制取的氯气中混有HCl气体杂质,所以将氯气通入装置A中反应之前要先通过饱和食盐水将HCl气体除去;装置A中氯气和潮湿的碳酸钠反应生成Cl2O气体,之后将气体通过足量的四氯化碳,除去混合气体中未反应和少量Cl2O分解产生的气体,通入水中,Cl2O与水反应生成次氯酸。
(7)反应完成后A中主要成分有反应生成的NaCl和NaHCO3,以及未反应的Na2CO3,所以样品的水溶液呈碱性,滴入盐酸先发生Na2CO3+HCl=NaHCO3+H2O,再发生NaHCO3+HCl=NaCl+CO2+H2O;第一个反应终点溶质为碳酸氢钠,溶液显碱性,滴定时用酚酞做指示剂,第二个反应终点溶质为NaCl,用甲基橙做指示剂。
(1)根据分析可知装置连接顺序为Cl2→C→A→B→D;
(2)装置A中氯气与潮湿的碳酸钠反应生成Cl2O,该过程为Cl2的歧化过程,由于水较少,生成的HCl较少,所以只能与碳酸钠反应生成碳酸氢钠,根据电子守恒和元素守恒可得方程式为:2Cl2+2Na2CO3+H2O=Cl2O+2NaCl+2NaHCO3;
(3)根据分析可知装置B的作用是除去Cl2O中混有的Cl2;加快整个反应速率的关键是加快氯气与潮湿碳酸钠的反应,据图可知本实验中采用了搅拌棒进行搅拌,同时采用多孔球泡装置,以增大接触面积加快反应速率;
(4)D装置中Cl2O与水反应制取HClO,元素化合价没有变化,根据元素守恒可得方程式为Cl2O+H2O=2HClO;
(5)根据题目信息可知Cl2O的沸点为3.8℃,E中液氨作制冷剂,可使Cl2O冷凝成液态,从而收集Cl2O;因氯气通入D装置之前已被除去,Cl2O与水反应并不产生气体,收集装置中温度较低Cl2O不会分解,所以逸出的气体主要成分为空气;
(6)制得的次氯酸溶液浓度较大,且制得的次氯酸溶液纯度较高,制得的次氯酸溶液不含有Cl-离子,而且此法的氯元素的利用率高;
(7)①根据分析可知碳酸钠转化为碳酸氢钠消耗的盐酸体积为V1mL,则n(Na2CO3)=0.1V1×10-3mol,反应生成的n(NaHCO3)=0.1V1×10-3mol;第二次滴定过程碳酸氢钠消耗的盐酸体积为V2mL,则n总(NaHCO3)=0.1V2×10-3mol,所以样品中n总(NaHCO3)=0.1V2×10-3mol-0.1V1×10-3mol,所以样品中碳酸钠的质量分数为![]() ×100%,碳酸氢钠的质量分数为
×100%,碳酸氢钠的质量分数为![]() ×100%;
×100%;
②若用甲基橙作指示剂滴定结束时,滴定管尖嘴有气泡,读取的HCl体积会偏小,此时测得n总(NaHCO3)会偏小,从而使碳酸氢钠的质量分数偏高,对碳酸钠的质量分数没有影响。

 互动英语系列答案
互动英语系列答案