题目内容
将H2(g)和Br2(g)充入恒容密闭容器,恒温下发生反应H2(g)+Br2(g) 2 HBr(g) ΔH<0平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是( )
2 HBr(g) ΔH<0平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是( )
| A.a>b | B.a=b | C.a<b | D.无法确定 |
A
解析试题分析:恒温下发生反应H2(g)+Br2(g)?2HBr(g)△H<0,该反应是放热反应,达到平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,容器中的温度比恒温容器中的温度高,所以化学平衡向逆向进行,平衡时Br2(g)的转化率减少,即b<a;选A.
考点:考查化学平衡的影响因素。

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
一定温度下,对可逆反应A(g)+2B(g) 3C(g)的下列叙述中,能说明反应已达到平衡的是( )
3C(g)的下列叙述中,能说明反应已达到平衡的是( )
| A.C生成的速率与C分解的速率相等 |
| B.单位时间内消耗amolA,同时生成3amolC |
| C.容器内的压强不再变化 |
| D.混合气体的物质的量不再变化 |
下列有关平衡常数(K、Ka、Kw、Ksp)的说法中错误的是
| A.若各平衡常数(K、Ka、Kw、Ksp)的值发生变化,则平衡一定发生移动 |
| B.若温度升高,则各平衡常数一定增大 |
| C.平衡常数的大小能说明反应(或电离、溶解)进行的程度 |
| D.某一可逆反应的平衡常数越大,表明反应(或电离、溶解)进行的程度越大 |
某温度下,X(g)+Y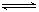 2Z反应达到平衡,在升高温度或减小压强的情况下,平衡均向右移动,则下列有关反应的各种叙述中正确的是
2Z反应达到平衡,在升高温度或减小压强的情况下,平衡均向右移动,则下列有关反应的各种叙述中正确的是
| A.正反应是吸热反应,Z是固体 |
| B.逆反应是放热反应,Y是固体,Z为气体 |
| C.正反应是吸热反应,只有Z不是气体 |
| D.正反应是放热反应,Y和Z均为气体 |
在一密闭容器中充入一定量的N2和H2,经测定反应开始后的2s内氢气的平均速率:ν(H2)=0.45mol/(L·s),则2s末NH3的浓度为
| A.0.50mol/L | B.0.60mol/L | C.0.45mol/L | D.0.55mol/L |
一定量混合物在密闭容器中发生反应:mA(g)+nB(g) pC(g)达平衡后,将气体体积缩小到原来的1/2,当达到新的平衡时,B物质的浓度为原来的1.9倍,若压缩过程中保持温度不变,则下列说法正确的是
pC(g)达平衡后,将气体体积缩小到原来的1/2,当达到新的平衡时,B物质的浓度为原来的1.9倍,若压缩过程中保持温度不变,则下列说法正确的是
| A.m+n<p | B.平衡向逆反应方向移动 | C.A的转化率降低 | D.C的体积分数增大 |
对于反应3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g)的平衡常数,下列说法正确的是
Fe3O4(s)+4H2(g)的平衡常数,下列说法正确的是
A.K=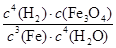 |
B.K=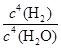 |
| C.增大c(H2O)或减小c(H2),会使该反应平衡常数减小 |
| D.改变反应的温度,平衡常数不一定变化 |
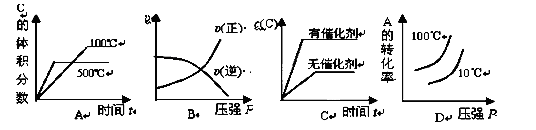
 2C(g) △H <0,下列各图正确的是( )
2C(g) △H <0,下列各图正确的是( )