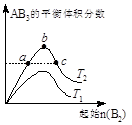题目内容
对于可逆反应:2A(g)+B(g)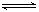 2C(g) △H <0,下列各图正确的是( )
2C(g) △H <0,下列各图正确的是( )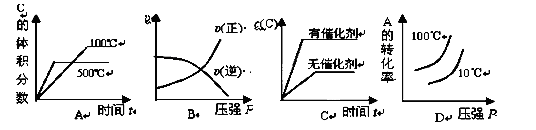
A
解析试题分析:A、该反应为放热反应,温度升高平衡向逆反应方向移动,C的质量分数减小,正确;B、根据反应前后的化学计量数的大小可以看出,增大压强平衡向正反应方向移动,正逆反应速率都增大,且V正>V逆,错误;C、催化剂同等程度地改变正逆反应速率,平衡不发生移动,C错误;D、该反应为放热反应,温度升高平衡向逆反应方向移动,A的转化率降低,根据反应前后的化学计量数的大小可以看出,增大压强平衡向正反应方向移动,A的转化率增大,本题温度的曲线不正确,错误。
考点:考查化学平衡图像及外界条件对速率平衡的影响。

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案可逆反应mA(固)+nB(气) eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述正确的是( )
eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述正确的是( )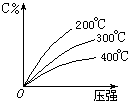
| A.达平衡后,加入催化剂则C%增大 |
| B.化学方程式中n>e+f |
| C.达平衡后,若升温,平衡右移 |
| D.达平衡后,增加A的量有利于平衡向右移动 |
100 mL浓度为2 mol·L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是
| A.加入适量的6 mol·L-1的盐酸 | B.加入数滴氯化铜溶液 |
| C.加入适量蒸馏水 | D.加入适量的氯化钠溶液 |
可逆反应2SO2(g) +O2(g) 2SO3(g)在不同条件下的反应速率如下,其中反应速率最快的是 ( )
2SO3(g)在不同条件下的反应速率如下,其中反应速率最快的是 ( )
| A.υ(SO2)=0.5mol/(L?s) | B.υ(O2)=1mol/(L?min) |
| C.υ(SO3)=0.6mol/(L?s) | D.υ(O2)=0.4mol/(L?s) |
将H2(g)和Br2(g)充入恒容密闭容器,恒温下发生反应H2(g)+Br2(g) 2 HBr(g) ΔH<0平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是( )
2 HBr(g) ΔH<0平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是( )
| A.a>b | B.a=b | C.a<b | D.无法确定 |
在下列反应中:A2(g)+B2(g) 2AB(g)(正反应放热),当其达到平衡时,在下图的曲线中,符合勒夏特列原理的曲线是
2AB(g)(正反应放热),当其达到平衡时,在下图的曲线中,符合勒夏特列原理的曲线是 
| A.①② | B.③④ | C.① | D.①⑤ |
在密闭容器中发生下列反应;aA(g) cC(g)+dD(g),达到平衡后将气体体积压缩到原来的一半,当再次达到新平衡时,D的浓度为原来的1.8倍,下列说法正确的是
cC(g)+dD(g),达到平衡后将气体体积压缩到原来的一半,当再次达到新平衡时,D的浓度为原来的1.8倍,下列说法正确的是
①平衡向正反应方向移动了 ②平衡向逆反应方向移动了
③A的转化率增大 ④正、逆速率都增大
| A.②④ | B.①③ | C.③④ | D.①② |
下列说法中有明显错误的是
| A.对有气体参加的化学反应,增大压强,体系体积减小,可使单位体积内活化分子数增加,因而反应速率增大 |
| B.活化分子之间发生的碰撞不一定为有效碰撞 |
| C.升高温度,一般可使活化分子的百分数增大,因而反应速率增大 |
| D.加入适宜的催化剂,可使活化分子的百分数大大增加,从而成千上万倍地增大化学反应的速率 |
 2AB3(g)化学平衡状态的影响,得到如右图所示的变化规律(T表示温度)。下列结论正确的是
2AB3(g)化学平衡状态的影响,得到如右图所示的变化规律(T表示温度)。下列结论正确的是