题目内容
反应A(g)+3B(g)=2C(g)+2D(g)在四种不同情况下的反应速率分别为
①v(A)=0.45 mol·L-1·min-1 ②v(B)=0.6 mol·L-1·s-1
③v(C)=0.4 mol·L-1·s-1 ④v(D)=0.45 mol·L-1·s-1
下列有关反应速率的比较中正确的是
A.④>③=②>① B.④<③=②<① C.①>②>③>④ D.④>③>②>①
A
解析试题分析:都用同种物质速率来表示,然后再比较其大小。不妨用A的速率来表示。②v(A)="1∕3" v(B)="0.2" mol·L-1·s-1③v(A)="1∕2" v(C)="0.2" mol·L-1·s-1④v(A) =1∕2v(D)=0.225 mol·L-1·s-1反应速率的比较中正确④>③=②>①。选项为:A.
考点:考查反应速率的大小比较的知识。

下列事实不能用勒夏特列原理解释的是
A.溴水中有下列平衡Br2+H2O HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅 HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅 |
| B.合成氨反应,为提高氨的产率,理论上应采取降低温度的措施 |
C.反应CO(g)+NO2(g) CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深 CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深 |
D.对于2HI(g) H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深 H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深 |
关于平衡常数,下列说法不正确的是
| A.平衡常数随温度的改变而改变 |
| B.使用催化剂不能改变平衡常数 |
| C.平衡常数不随反应物或生成物浓度的改变而改变 |
| D.增大压强促使平衡向正反应方向进行,则平衡常数增大 |
可逆反应2SO2(g) +O2(g) 2SO3(g)在不同条件下的反应速率如下,其中反应速率最快的是 ( )
2SO3(g)在不同条件下的反应速率如下,其中反应速率最快的是 ( )
| A.υ(SO2)=0.5mol/(L?s) | B.υ(O2)=1mol/(L?min) |
| C.υ(SO3)=0.6mol/(L?s) | D.υ(O2)=0.4mol/(L?s) |
将1.0 mol PCl3和1.0 mol Cl2充入体积不变的密闭容器中,一定条件下发生反应:PCl3(g)+ Cl2(g) PCl5(g),达到平衡时PCl5为0.3mol·L-1,如果此时再充入1.0 molPCl3和1.0 mol Cl2,在相同温度下再达到平衡时,PCl5的物质的量浓度是
PCl5(g),达到平衡时PCl5为0.3mol·L-1,如果此时再充入1.0 molPCl3和1.0 mol Cl2,在相同温度下再达到平衡时,PCl5的物质的量浓度是
| A.0.6mol·L-1 | B.大于0.3 mol·L-1,小于0.6 mol·L-1 |
| C.大于0.6 mol·L-1 | D.小于0.3 mol·L-1 |
将H2(g)和Br2(g)充入恒容密闭容器,恒温下发生反应H2(g)+Br2(g) 2 HBr(g) ΔH<0平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是( )
2 HBr(g) ΔH<0平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是( )
| A.a>b | B.a=b | C.a<b | D.无法确定 |
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq) I3-(aq),某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是
I3-(aq),某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是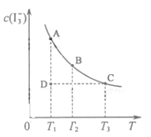
A.反应 I2(aq)+I-(aq) I3-(aq)的ΔH<0 I3-(aq)的ΔH<0 |
B.若温度为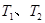 ,反应的平衡常数分别为K1、K2,则K1>K2 ,反应的平衡常数分别为K1、K2,则K1>K2 |
C.若反应进行到状态D时,一定有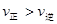 |
| D.状态A与状态B相比,状态A的c(I2)大 |
在温度、容积相同的2个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1 mol N2、3 mol H2 | 4 mol NH3 |
| NH3的浓度(mol·L-1) | c1 | c2 |
| 反应的能量变化 | 放出a kJ | 吸收b kJ |
| 气体密度 | ρ1 | ρ2 |
| 反应物转化率 | α1 | α2 |
 (已知N2(g)+3H2(g) 2NH3(g);ΔH=-92.4 kJ·mol-1),下列说法正确的是( )
(已知N2(g)+3H2(g) 2NH3(g);ΔH=-92.4 kJ·mol-1),下列说法正确的是( )A.c1<c2<2c1 B.a+b>92.4 C.α1+α 2=1 D.ρ2=2ρ1