题目内容
在一密闭容器中充入一定量的N2和H2,经测定反应开始后的2s内氢气的平均速率:ν(H2)=0.45mol/(L·s),则2s末NH3的浓度为
| A.0.50mol/L | B.0.60mol/L | C.0.45mol/L | D.0.55mol/L |
B
解析试题分析:根据反应的化学方程式为:N2+3H2 2NH3可得 :V(H2):V(NH3 )="3:2" 。V(NH3 )=(2∕3)V(H2)= (2∕3)×0.45mol/(L·s)="0.30" mol/(L·s)。所以2s末NH3的浓度为:C(NH3)="Δt" ·V(NH3 )="2s×=0.30" mol/(L·s)="0.60" mol/L。选项为:B。
2NH3可得 :V(H2):V(NH3 )="3:2" 。V(NH3 )=(2∕3)V(H2)= (2∕3)×0.45mol/(L·s)="0.30" mol/(L·s)。所以2s末NH3的浓度为:C(NH3)="Δt" ·V(NH3 )="2s×=0.30" mol/(L·s)="0.60" mol/L。选项为:B。
考点:考查在化学反应方程式中个物质的速率关系。

 黄冈创优卷系列答案
黄冈创优卷系列答案一定温度下反应N2+O2 2NO在密闭容器中进行,下列措施不改变化学反应速率的是
2NO在密闭容器中进行,下列措施不改变化学反应速率的是
| A.缩小体积使压强增大 | B.恒容,充入N2 |
| C.恒容,充入He | D.恒压,充入He |
可逆反应2SO2(g) +O2(g) 2SO3(g)在不同条件下的反应速率如下,其中反应速率最快的是 ( )
2SO3(g)在不同条件下的反应速率如下,其中反应速率最快的是 ( )
| A.υ(SO2)=0.5mol/(L?s) | B.υ(O2)=1mol/(L?min) |
| C.υ(SO3)=0.6mol/(L?s) | D.υ(O2)=0.4mol/(L?s) |
将H2(g)和Br2(g)充入恒容密闭容器,恒温下发生反应H2(g)+Br2(g) 2 HBr(g) ΔH<0平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是( )
2 HBr(g) ΔH<0平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是( )
| A.a>b | B.a=b | C.a<b | D.无法确定 |
在下列反应中:A2(g)+B2(g) 2AB(g)(正反应放热),当其达到平衡时,在下图的曲线中,符合勒夏特列原理的曲线是
2AB(g)(正反应放热),当其达到平衡时,在下图的曲线中,符合勒夏特列原理的曲线是 
| A.①② | B.③④ | C.① | D.①⑤ |
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq) I3-(aq),某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是
I3-(aq),某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是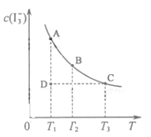
A.反应 I2(aq)+I-(aq) I3-(aq)的ΔH<0 I3-(aq)的ΔH<0 |
B.若温度为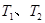 ,反应的平衡常数分别为K1、K2,则K1>K2 ,反应的平衡常数分别为K1、K2,则K1>K2 |
C.若反应进行到状态D时,一定有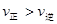 |
| D.状态A与状态B相比,状态A的c(I2)大 |
在密闭容器中发生下列反应;aA(g) cC(g)+dD(g),达到平衡后将气体体积压缩到原来的一半,当再次达到新平衡时,D的浓度为原来的1.8倍,下列说法正确的是
cC(g)+dD(g),达到平衡后将气体体积压缩到原来的一半,当再次达到新平衡时,D的浓度为原来的1.8倍,下列说法正确的是
①平衡向正反应方向移动了 ②平衡向逆反应方向移动了
③A的转化率增大 ④正、逆速率都增大
| A.②④ | B.①③ | C.③④ | D.①② |
将2.0molPCl3,和1.0molCl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g) PCl5(g)达到平衡时,PCl5为0.40mol,如果此时移走1.0molPCl3和0.50molCl2,在相同温度下再达平衡时PCl5的物质的量是
PCl5(g)达到平衡时,PCl5为0.40mol,如果此时移走1.0molPCl3和0.50molCl2,在相同温度下再达平衡时PCl5的物质的量是
| A.0.40mol | B.小于0.20mol | C.0.20mol | D.大于0.20mol,小于0.40mol |
在恒温、容积为2 L的密闭容器中充入2 mol SO2和一定量O2。发生反应2SO2+O2? ?2SO3,当反应进行到4 min时,测得n (SO2)=0.4 mol。若反应进行到2 min时,容器中SO2的物质的量是( )
?2SO3,当反应进行到4 min时,测得n (SO2)=0.4 mol。若反应进行到2 min时,容器中SO2的物质的量是( )
| A.等于1.6 mol | B.等于1.2 mol |
| C.大于1.6 mol | D.小于1.2 mol |