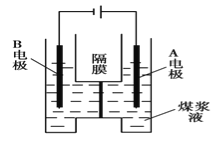
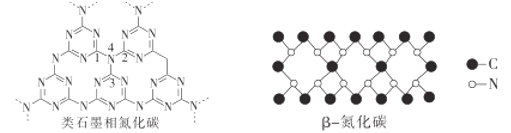
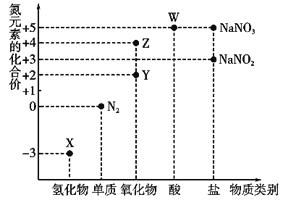
题目内容
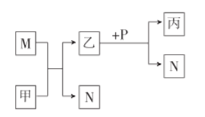
【题目】X、Y、Z、W是原子序数依次增大的短周期主族元素。甲、乙、丙是由这些元素组成的化合物,M、N、P是这些元素对应的单质,甲常温下为液态,丙中滴入盐酸开始有沉淀,继续沉淀消失,其溶液呈碱性。上述物质间的转化关系如图所示。下列说法错误的是( )
A.原子半径:Z>W>Y
B.X与Z形成的化合物能与水反应产生N
C.常温下,P不能与浓硝酸发生反应
D.Y分别与X、Z形成的化合物均不止一种
【答案】C
【解析】
甲常温下为液态,应为H2O,丙中滴入盐酸开始有沉淀,继续沉淀消失,其溶液呈碱性,可知丙为NaAlO2,由转化关系可知M为Na,N为H2,乙为NaOH,P为Al,由此可知X、Y、Z、W分别为H、O、Na、Al元素,据此分析解答。
由以上分析可知X、Y、Z、W分别为H、O、Na、Al元素。
A.原子核外电子层数越多,原子半径越大,同周期元素,从左到右,原子半径减小,则原子半径![]() ,即Z>W>Y,故A正确;
,即Z>W>Y,故A正确;
B.X与Z形成的化合物为NaH,具有还原性,可与水发生氧化还原反应,生成氢氧化钠和氢气,故B正确;
C.常温下,铝与浓硝酸发生钝化反应,钝化属于化学变化,故C错误;
D.氧元素可与氢、钠两元素分别形成过氧化氢、水,过氧化钠、氧化钠等化合物,形成的化合物均不止一种,故D正确;
故选C。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目