题目内容
【题目】2019年的化学诺贝尔奖颁给了为锂电池研究作出贡献的三位科学家,其研究的是两种常见锂电池:一种是采用镍钴锰酸锂Li(NiCoMn)O2或镍钴铝酸锂为正极的“三元材料锂电池”;另一种是采用磷酸铁锂(LiFePO4)为正极的电池。请回答下列问题:
(1)利用FeSO4、(NH4)2HPO4、LiOH为原料以物质的量之比1∶1∶1反应生成LiFePO4,该化学反应方程式为________________。
(2)Mn位于元素周期表的_____区(填“s”或“p”或“d”或“ds”或“f”),基态钴原子的未成对电子数为______,1mol [CoCl (NH3)5] Cl2 中含σ键数目为__NA。
(3)磷元素可以形成多种含氧酸H3PO4、H3PO2、H3PO3、HPO3,这四种酸中酸性最强的是_____。PO43-的空间构型是___,中心原子的杂化方式是______。
(4)PH3是_____分子(填“极性”或“非极性”),其在水中的溶解性比NH3小,原因是______。
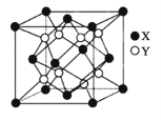
(5)硫化锂Li2S(摩尔质量Mgmol-1)的纳米晶体是开发先进锂电池的关键材料,硫化锂的晶体为反萤石结构,其晶胞结构如图。若硫化锂晶体的密度为ag·cm-3,则距离最近的两个S2-的距离是_______nm。(用含a、M、NA的计算式表示)
【答案】FeSO4+(NH4)2HPO4+LiOH=LiFePO4+(NH4)2SO4+H2O 3 d 21 HPO3 正四面体 sp3 极性 NH3能与水分子形成氢键,而PH3不能,所以在水中的溶解性PH3小 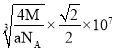
【解析】
(1)已知反应物为FeSO4、(NH4)2HPO4、LiOH且物质的量之比为1:1:1,即计量数之比为1:1:1,已知产物有LiFePO4,根据元素守恒可得方程式为:FeSO4+(NH4)2HPO4+LiOH=LiFePO4+(NH4)2SO4+H2O;
(2)Mn位于元素周期表的第四周期第ⅦB族,属于d区;Co元素是27号元素,基态Co原子核外电子排布式为:[Ar]3d74s2,3d上有3个成对电子;[CoCl (NH3)5] Cl2 中Cl-和5个NH3与Co3+之间形成6个配位键,为σ键,每个氨气分子中每个氢原子和氮原子之间形成一个σ键,共6+5×3=21个,所以1mol [CoCl (NH3)5] Cl2 中含σ键数目为21NA;
(3)H3PO4、H3PO2、H3PO3、HPO3可改写成(HO)3PO、(HO)2PO、(HO)3P、(HO)PO2,非羟基氧原子个数分别为1、1、0、2,非羟基氧数目越多,酸性越强,则酸性最强的是,HPO3;PO43-的中心原子价层电子对数为![]() =4,不含孤电子对,所以为正四面体构型,采取sp3杂化;
=4,不含孤电子对,所以为正四面体构型,采取sp3杂化;
(4)PH3空间构型为三角锥性,P原子位于顶点,所以正负电荷中心不重合,为极性分子;NH3能与水分子形成氢键,而PH3不能,所以在水中的溶解性PH3小;
(5)根据均摊法,晶胞中X的个数为![]() =4,Y的个数为8,该晶体的化学式为Li2S,所以X代表S2-,Y代表Li+,根据晶胞结构示意图可知,距离最近的两个S2-的距离为面对角线的一半,已知晶胞的密度为ag·cm-3,晶胞的质量m=
=4,Y的个数为8,该晶体的化学式为Li2S,所以X代表S2-,Y代表Li+,根据晶胞结构示意图可知,距离最近的两个S2-的距离为面对角线的一半,已知晶胞的密度为ag·cm-3,晶胞的质量m=![]() g,则晶胞的棱长为
g,则晶胞的棱长为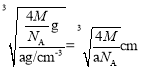 ,所以距离最近的两个S2-的距离为
,所以距离最近的两个S2-的距离为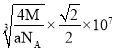 nm。
nm。