题目内容
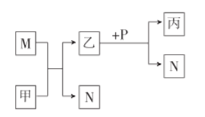
【题目】利用元素的化合价推测物质的性质是化学研究的重要手段,氮元素的常见化合价与部分物质类别的对应关系如图所示。
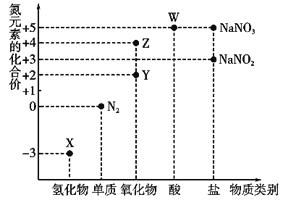
(1)从氮元素化合价的角度分析,X、Y、Z、W中既具有氧化性又具有还原性的有______(填化学式)。
(2) N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为_______________。尾气中的NO用酸性NaClO溶液吸收,其原理是HClO氧化NO生成Cl和NO3-,其离子方程式为______________________________________。
(3)将集满红棕色气体Z的试管倒置于盛有水的水槽中,观察到的现象为_______________________。
(4)W的稀溶液与铜单质发生反应的离子方程式为__________________________。
(5)已知NaNO2能被酸性KMnO4溶液氧化为NaNO3,则50mL0.01 mol·L-1 NaNO2溶液与10mL0.02 mol·L-1 KMnO4溶液恰好完全反应时,还原产物中Mn元素的化合价为__________________________。
【答案】NO、NO2 2NH3+2O2 N2O+3H2O 3HClO+2NO+H2O=3Cl+2 NO3-+5H+ 试管内液面逐渐上升至试管容积的2/3左右,红棕色气体逐渐变为无色气体 3Cu + 2NO3- + 8H+ = 3Cu2+ + 2NO↑+4H2O +2
N2O+3H2O 3HClO+2NO+H2O=3Cl+2 NO3-+5H+ 试管内液面逐渐上升至试管容积的2/3左右,红棕色气体逐渐变为无色气体 3Cu + 2NO3- + 8H+ = 3Cu2+ + 2NO↑+4H2O +2
【解析】
由化合价可知X为NH3,Y为NO,Z为NO2,W为HNO3,
(1)从氮元素化合价变化的角度分析,如既有氧化性,也有还原性,则N元素化合价为中间价态;
(2)NH3与O2在加热和催化剂作用下生成N2O,类似于生成NO的反应,同时生成水;在酸性NaClO溶液中,HClO氧化NO生成Cl-和NO3-,反应后溶液呈酸性;
(3)二氧化氮与水反应生成NO和HNO3;
(4)稀硝酸与铜反应生成硝酸铜和NO;
(5)结合氧化还原反应得失电子守恒计算。
由化合价可知X为NH3,Y为NO,Z为NO2,W为HNO3,
(1)从氮元素化合价变化的角度分析,如既有氧化性,也有还原性,则N元素化合价为中间价态,可为NO、NO2;
(2)NH3与O2在加热和催化剂作用下生成N2O和水,反应的化学方程式为2NH3+2O2![]() N2O+3H2O;在酸性NaClO溶液中,HClO氧化NO生成Cl-和NO3-,反应后溶液呈酸性,则反应的离子方程式为3HClO+2NO+H2O=3Cl-+2NO3-+5H+;
N2O+3H2O;在酸性NaClO溶液中,HClO氧化NO生成Cl-和NO3-,反应后溶液呈酸性,则反应的离子方程式为3HClO+2NO+H2O=3Cl-+2NO3-+5H+;
(3)二氧化氮和水反应生成硝酸和一氧化氮:3NO2+H2O=2HNO3+NO,一氧化氮是无色气体,二氧化氮是红棕色气体,二氧化氮和水反应后气体压强减小,外界大气压不变,所以外界大气压对水作用而使水进入试管中,3体积NO2转化为1体积NO,所以现象为试管内液面逐渐上升至试管容积的2/3左右,红棕色气体逐渐变为无色气体;
(4)稀硝酸与铜反应生成硝酸铜和NO,反应的离子方程式为3Cu+8H++2NO3﹣=3Cu2++2NO↑+4H2O;
(5)50mL0.01molL﹣1 NaNO2溶液中n(NaNO2)=0.05L×0.01mol/L=5×10﹣4mol,10mL0.02molL﹣1 KMnO4溶液中n(KMnO4)=0.01L×0.02mol/L=2×10﹣4mol,二者恰好完全反应时,设还原产物中Mn元素的化合价为x,则5×10﹣4mol×2=2×10﹣4mol×(7﹣x),解得x=+2。