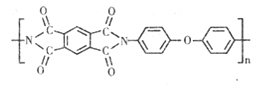
题目内容
【题目】近期瑞士科学院研发出一种负载氧化铜的纳米晶粒的聚合物氮化碳二维纳米材料(类石墨相氮化碳),大幅度提高水分解的催化效率,将为实现氢能源大规模应用打下坚实的基础。回答下列问题:
(1)铜在周期表中的位置为___,其原子核外电子排布的最高能层符号为___。
(2)1989年A.Y.Liu和M.L.Cohen根据β-氮化硅的晶体结构,用C替换Si,从理论上预言了β-氮化碳这种硬度可以和金刚石相媲美的新共价化合物。
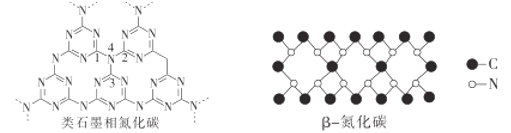
①石墨晶体可以一层层剥离开来,层间的作用力主要是___。
②类石墨相氮化碳中1、2、3、4共四个原子的空间构型为___;β-氮化碳中N的杂化类型是___。
③β-氮化碳的化学式为___;从化学键键长的角度分析金刚石、β-氮化碳的硬度大小:__。
(3)CuO晶胞如图:
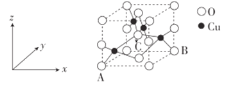
①若氧化铜晶胞中原子坐标参数A为(0,0,0),B为(1,1,0),则C原子坐标参数为___。
②NA代表阿伏加德罗常数的值,晶胞参数为anm,则晶体密度为__g·cm-3(用代数式表示)。
【答案】第四周期ⅠB族 N 范德华力 三角锥形 sp3 C3N4 β—氮化碳>金刚石 (![]() ,
,![]() ,
,![]() )
) ![]()
【解析】
(1)Cu是29号元素,根据核外电子的排布规律及电子排布式分析解答;
(2)①石墨层与层可剥离开应该考虑是较为微弱的作用而不是化学键;②结合类石墨相氮化碳结构可知4号氮原子以单键结合1、2、3号碳原子,N为sp3杂化;β-氮化碳中N也与三个碳原子结合成键,从而可判断杂化类型;③结合结构,利用均摊法确定化学式;根据原子半径确定键长的大小,键长越短键能越大,物质的硬度越高;
(3)①根据A、B两点的坐标及晶胞中C的相对位置,即可确定C的坐标;②先利用均摊法确定晶胞中的原子个数计算出晶胞质量,再利用晶胞参数确定晶胞体积,最后计算晶胞密度。
(1)Cu是29号元素,根据核外电子的排布规律,其核外电子排布为:[Ar]3d104s1,故铜在周期表中位于第四周期IB族,最高能层为N,故答案为:第四周期IB族;N;
(2)①石墨层与层之间没有共价键连接,主要是分子间的作用力(范德华力),而范德华力较弱,因此石墨晶体可以一层层剥离开来,故答案为:范德华力;
②4个原子中1个N,3个C,N与周围的3个碳原子结合,且含有一个孤对电子,N为sp3杂化,空间构型为三角锥形;观察β-氮化碳结构可知,N与周围的3个碳原子结合,且含有一个孤对电子,N为sp3杂化,故答案为:三角锥形;sp3;
③利用均摊法可得β-氮化碳的化学式为C3N4;C-C键的键长大于C-N键,故C-C键的键能小于C-N键,所以硬度:β-氮化碳>金刚石,故答案为:C3N4;β-氮化碳>金刚石;
(3)①由坐标图和晶胞图可知,A为(0,0,0),B为(1,1,0),C位于体心,则C的坐标为(![]() ,
,![]() ,
,![]() ),故答案为:(
),故答案为:(![]() ,
,![]() ,
,![]() );
);
②晶胞参数为anm,晶胞体积V=(a×10-7cm)3,观察氧化铜晶胞图,1个晶胞含4个“CuO”,则晶胞质量m=![]() g,故晶胞密度ρ=
g,故晶胞密度ρ=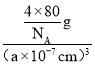 =
=![]() gcm3,故答案为:
gcm3,故答案为:![]() 。
。