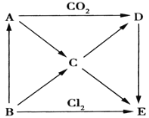
题目内容
【题目】某研究性学习小组为研究水垢的生成,查得CaCO3和Mg(OH)2溶解度曲线如图所示。已知:40°C时,Ksp(MgCO3)=7×10-6,下列有关分析错误的是( )

A.CaCO3、Mg(OH)2溶解均放热
B.MgCl2溶液中加入少量CaCO3粉末加热搅拌,有Mg(OH)2生成
C.含有Ca(HCO3)2和Mg(HCO3)2的自来水长时间加热,水垢的主要成分为CaCO3和MgCO3
D.40℃时,Ksp(CaCO3)=1.6×10-7
【答案】C
【解析】
A.由CaCO3和Mg(OH)2溶解度曲线图可知两者的溶解度随温度的升高而降低,说明升高温度,溶解平衡均向生成沉淀的方向移动;即CaCO3、Mg(OH)2溶解均是放热过程,故A正确;
B.MgCl2溶液中存在镁离子的水解平衡,Mg2++2H2OMg(OH)2+H+,加入CaCO3粉末后消耗了H+,c(H+)减小,水解平衡正向移动,有Mg(OH)2生成,故B正确;
C.自来水中的Ca(HCO3)2和Mg(HCO3)2受热分解为CaCO3和MgCO3,长时间加热,Mg2++2H2OMg(OH)2+H+,CO32-+H2OHCO3-+OH-,相互促进水解,MgCO3进一步转化为更难溶的Mg(OH)2,故C错误;
D.40℃时,碳酸钙的溶解度为40mg/L,将40mg/L转化为物质的量浓度为![]() =4×10-4mol/L;CaCO3饱和溶液中存在溶解平衡,CaCO3Ca2++CO32-,则Ksp(CaCO3)=c(Ca2+)c(CO32-)=4×10-4mol/L×4×10-4mol/L=1.6×10-7,故D正确;
=4×10-4mol/L;CaCO3饱和溶液中存在溶解平衡,CaCO3Ca2++CO32-,则Ksp(CaCO3)=c(Ca2+)c(CO32-)=4×10-4mol/L×4×10-4mol/L=1.6×10-7,故D正确;
故选C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目