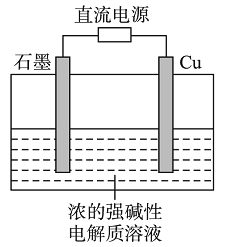
题目内容
【题目】用惰性电极电解煤浆液的方法制H2的反应为C(s)+2H2O(l)=CO2(g)+2H2(g)。现将一定量的1mol/LH2SO4溶液和适量煤粉充分混合,制成含碳量为0.02g/mL~0.12g/mL的煤浆液,置于如图所示装置中进行电解(两电极均为惰性电极)。下列说法错误的是
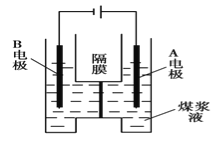
A. A极是阳极,B极为阴极
B. A极的电极反应式为C+2H2O-4e-=CO2↑+4H+
C. B极的电极反应式为2H++2e-=H2↑
D. 电解一段时间后,煤浆液的pH增大
【答案】D
【解析】
试题A.A极连接电源的正极是阳极,则B极为阴极,正确;B.阳极上发生氧化反应,A极的电极反应式为C+2H2O-4e-=CO2↑+4H+,正确;C.阴极上发生还原反应,B极的电极反应式为2H++2e-=H2↑,正确。D.电解的总反应式为C(s)+2H2O(l)=CO2(g)+2H2(g),可知电解一段时间后,煤浆液中水的量减少,硫酸溶液的浓度增大,溶液的pH减小,错误;答案为D。

练习册系列答案
 名题金卷系列答案
名题金卷系列答案
相关题目