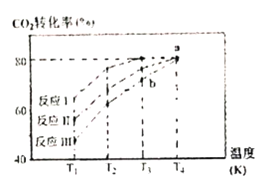
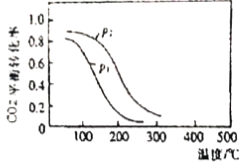
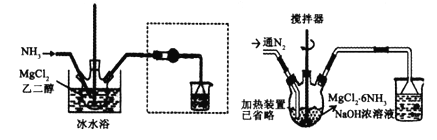
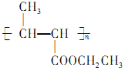题目内容
【题目】有U、V、W、X四种短周期元素,原子序数依次增大,其相关信息如下表:

请回答下列问题:
(1)U、V两种元素组成的一种化合物甲是重要的化工原料,常把它的产量作为衡量石油化工发展水平的标志,则甲分子中σ键和π键的个数比为________,其中心原子采取______杂化。
(2)V与W原子结合形成的V3W4晶体,其硬度比金刚石大,则V3W4晶体中含有________键,属于________晶体。
(3)乙和丙分别是V和X的氢化物,这两种氢化物分子中都含有18个电子。乙和丙的化学式分别是________、____________,两者沸点的关系为:乙________丙(填“>”或“<”),原因是______________。
【答案】5∶1 sp2 共价 原子 C2H6 H2O2 < H2O2分子间存在氢键,C2H6分子间不存在氢键
【解析】
根据核外电子排布规律分析解答;根据共价键的形成及分类分析解答;根据分子间作用力的综合利用分析解答;
根据题意已知,U是H元素;V元素三个能级,说明只有2个电子层,且每个能级中电子数相等,它的核外电子排布式为:1s22s22p2,即C元素;W在基态时,2p轨道处于半充满状态,所以它的核外电子排布式为:1s22s22p3,即N元素;X与W同周期,说明X处于第二周期,且X的第一电离能比W小,故X是O元素;
(1) 衡量石油化工发展水平的标志的是乙烯,即甲分子是乙烯分子,乙烯分子中含有碳碳双键,双键中含有一个σ键和一个π键,两个碳氢共价键,即四个σ键,则甲分子中σ键和π键的个数比为:5∶1,其中心原子采取的是sp2杂化,体现平面结构;
(2) V3W4晶体是C3N4晶体,其硬度比金刚石大,说明晶体中含有共价键,是原子晶体;
(3) V的氢化物含有18个电子,该分子是C2H6,W的氢化物含有18个电子的分子是:H2O2,由于H2O2分子间存在氢键,C2H6分子间不存在氢键,故沸点:C2H6<H2O2;