题目内容
【题目】“绿色”和“生态文明”是未来的发展主题,而CO2的有效利用可以缓解温室效应,解决能源短缺问题;
(1)在新型纳米催化剂 Na-Fe3O4,和HMCM-22的表面将CO2先转化为烯烃再转化为烷烃,已知CO2转化为CO的反应为CO2(g)+H2(g)=CO(g)+H2O(g) △H=+41kJ/mol;
2 CO2 (g)+6H2(g)=C2H4(g)+4 H2O (g) △H=-128kJ/mol
则CO转化为C2H4的热化学方程式为______________________。
(2)用氨水捕捉烟气中的CO2生成NH4CO3。通常情况下,控制反应温度在35℃-40℃范围内的原因___________。
(3)有科学家提出可利用FeO吸收CO2,6FeO(s)+CO2(g)![]() 2Fe3O4(s)+C(s) K1(平衡常数),对该反应的描述正确的是______
2Fe3O4(s)+C(s) K1(平衡常数),对该反应的描述正确的是______
a.生成 1mol Fe3O4时电子转移总数为2NA
b.压缩容器体积,可增大CO2的转化率,c(CO2)减小
C.恒温恒容下,气体的密度不变可作为平衡的标志
d.恒温恒压下,气体摩尔质量不变可作为平衡的标志
(4)CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H,一定条件下,向2L恒容密闭容器中充入1 molCO2和3mo1H2。在不同催化剂作用下发生反应I、反应II、反应II,相同时间内CO2的转化率随温度变化如图所示:
CH3OH(g)+H2O(g) △H,一定条件下,向2L恒容密闭容器中充入1 molCO2和3mo1H2。在不同催化剂作用下发生反应I、反应II、反应II,相同时间内CO2的转化率随温度变化如图所示:
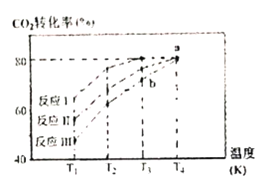
①活化能最小的为___________(填“反应I”、“反应II”、“反应III”)。
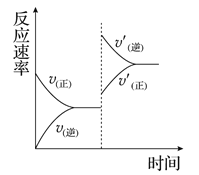
②b点反应速率v(正)___________v(逆)(填“>”、“=”或“<”)。
③T4温度下该反应的衡常数___________(保留两位有效数字)
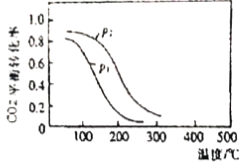
④CO2的平衡转化率与温度、压强的关系如图所示:则该反应为___________(放热反应、吸热反应);P1___________P2(填“>”、“=”或“<”)
(5)用NaOH溶液吸收CO2所得饱和碳酸钠溶液可以对废电池屮的铅膏(主要成PbSO4)进行脱硫反应。已知Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)=7.4×10-14,PbSO4(s)+CO32-(aq)![]() PbCO3(s)+SO42-(aq),则该反应的平衡常数K=___________(保留两位有效数字):若在其溶液中加入少量Pb(NO3)2晶体,则c(SO42-):c(CO32-)的比值将___________(填“增大”、“减小”或“不变”)。
PbCO3(s)+SO42-(aq),则该反应的平衡常数K=___________(保留两位有效数字):若在其溶液中加入少量Pb(NO3)2晶体,则c(SO42-):c(CO32-)的比值将___________(填“增大”、“减小”或“不变”)。
【答案】2CO(g)+4H2(g) =C2H4(g)+2H2O(g)△H=-210kJ/mol 防止NH4HCO3分解,低于35℃反应速率慢高于40℃分解(或温度太高,气体物质的溶解性降低) ac 反应I > 59.26(或1600/27) 放热反应 < 2.16×105 不变
【解析】
(1)已知CO2(g)+H2(g)=CO(g)+H2O(g) △H=+41kJ/mol①;2CO2(g)+6H2(g)=C2H4(g)+4H2O(g) △H=-128kJ/mol②;由盖斯定律②-①×2可得:2CO(g)+4H2(g)=C2H4(g)+2H2O(g) △H=(-128kJ/mol)-(+41kJ/mol)×2=-210kJ/mol,则CO转化为C2H4的热化学方程式为2CO(g)+4H2(g)=C2H4(g)+2H2O(g) △H=-210kJ/mol,
故答案为:2CO(g)+4H2(g)=C2H4(g)+2H2O(g) △H=-210kJ/mol。
(2)通常情况下,控制反应温度在35℃-40℃范围内,因为温度低于35℃,反应速率慢;高于40℃,NH4HCO3受热易分解(或温度太高,气体物质的溶解性降低),故答案为:防止NH4HCO3分解,低于35℃反应速率慢高于40℃分解(或温度太高,气体物质的溶解性降低)。
(3)a.由6FeO(s)+CO2(g)![]() 2Fe3O4(s)+C(s)可知,反应方程式FeO中铁元素化合价+2升至Fe3O4中+8/3,CO2由+4降至C中碳元素的0价,每生成1molC转移电子4mol,生成Fe3O42mol,则生成1molFe3O4转移电子2mol,电子转移总数为2NA,故a正确;
2Fe3O4(s)+C(s)可知,反应方程式FeO中铁元素化合价+2升至Fe3O4中+8/3,CO2由+4降至C中碳元素的0价,每生成1molC转移电子4mol,生成Fe3O42mol,则生成1molFe3O4转移电子2mol,电子转移总数为2NA,故a正确;
b.压缩容器体积实质为增大压强,反应前后气体体积减小,平衡向逆反应方向移动,CO2的转化率减小,c(CO2)增大,故b错误;
c.恒温恒容下,气体的密度ρ=m/V,若密度不变,说明CO2的质量不变,则CO2的浓度不变,可以作为达到平衡的标志,故c正确;
d.恒温恒压下,气体摩尔质量M=m/n,摩尔质量不变不能作为达到平衡的标志,故d错误。
故答案为:ac。
(4)①相同温度下,相同时间内反应I中CO2的转化率越大,所以催化效果最佳的是反应I,活化能也最小,故答案为:反应I。
②b点要达到平衡,CO2的转化率增大,反应正向进行,故反应速率v(正)>v(逆),故答案为:>。
③一定条件下,向2L恒容密闭容器中充入1molCO2和3mo1H2,由图像可知,T4温度下,CO2的平衡转化率为80%,则转化的CO2的物质的量浓度为1mol/2L×80%=0.4mol/L,
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
开始(mol/L) 0.5 1.5 0 0
转化(mol/L) 0.4 1.2 0.4 0.4
平衡(mol/L) 0.1 0.3 0.4 0.4
T4温度下该反应的平衡常数K=c(CH3OH)c(H2O)/c3(H2)c(CO2)=0.4×0.4/(0.3)3×0.1=59.26,故答案为:59.26(或1600/27)。
④由图可知,相同压强时,温度越高,CO2的转化率越小,可以知道该反应为放热反应,升高温度平衡逆向移动,△H<0;由反应可知,减小压强平衡逆向移动,由图可知,相同温度时,P2对应的转化率增大,P1<P2,即该反应为气体体积减小的反应,压强越大,转化率越大,故答案为:放热反应,<。
(5)根据方程式PbSO4(s)+CO32-(aq)![]() PbCO3(s)+SO42-(aq)可知反应的平衡常数K=c(SO42-)/c(SO42-)=c(SO42-)c(Pb2+)/c(SO42-)c(Pb2+)= Ksp(PbSO4)/Ksp(PbCO3)=1.6×10-8/7.4×10-14=2.16×105,若在其溶液中加入少量Pb(NO3)2晶体,由于平衡常数只与温度有关系,则根据该反应的平衡常数表达式可知c(SO42-):c(CO32-)的比值不变,故答案为:2.16×105,不变。
PbCO3(s)+SO42-(aq)可知反应的平衡常数K=c(SO42-)/c(SO42-)=c(SO42-)c(Pb2+)/c(SO42-)c(Pb2+)= Ksp(PbSO4)/Ksp(PbCO3)=1.6×10-8/7.4×10-14=2.16×105,若在其溶液中加入少量Pb(NO3)2晶体,由于平衡常数只与温度有关系,则根据该反应的平衡常数表达式可知c(SO42-):c(CO32-)的比值不变,故答案为:2.16×105,不变。

 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案