题目内容
6.已知1g氢气完全燃烧生成水蒸气时放出热量121kJ,且氧气中1molO=O键完全断裂时吸收热量496kJ,水蒸气中1mol H-O键形成时放出热量463kJ,则氢气中1mol H-H键断裂时吸收热量为436KJ.分析 化学反应放出的热量=新键生成释放的能量-旧键断裂吸收的能量,依此结合反应方程式进行计算.
解答 解:氢气完全燃烧生成水蒸气是放热反应,所以化学反应放出的热量=新键生成释放的能量-旧键断裂吸收的能量,设氢气中1molH-H键断裂时吸收热量为Q,根据方程式:2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,则:4×121kJ=4×463kJ-(2Q+496kJ),解得Q=436KJ,
故答案为:436KJ.
点评 本题考查反应热的相关计算,难度不大,抓住化学反应放出的热量=新键生成释放的能量-旧键断裂吸收的能量计算即可.

练习册系列答案
 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案
相关题目
16.下列说法中正确的是( )
| A. | 主族元素的原子及其离子的核外电子层数等于该元素所在的周期数 | |
| B. | 元素周期表中从ⅢB到ⅡB族10个纵行的元素都是金属元素 | |
| C. | 稀有气体原子的最外层电子数都是8 | |
| D. | 互为同位素的元素物理性质、化学性质均相同 |
17.下列物质中,既含离子键、又含共价键的是( )
| A. | NaOH | B. | Na2O | C. | H2O | D. | CaCl2 |
14.制取纯净的一氯乙烷的最佳方法是( )
| A. | 乙烷和氯气在一定条件下发生取代反应 | |
| B. | 乙烯和氯气在一定条件下发生加成反应 | |
| C. | 乙炔与氯化氢加成后再加氢 | |
| D. | 乙烯与氯化氢发生加成反应 |
18.下列物质一定属于同系物的是( )
①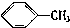 ②
②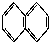 ③
③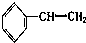 ④C2H4 ⑤CH2=CH-CH=CH2 ⑥C3H6 ⑦
④C2H4 ⑤CH2=CH-CH=CH2 ⑥C3H6 ⑦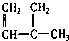 ⑧
⑧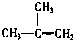
①
 ②
② ③
③ ④C2H4 ⑤CH2=CH-CH=CH2 ⑥C3H6 ⑦
④C2H4 ⑤CH2=CH-CH=CH2 ⑥C3H6 ⑦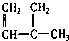 ⑧
⑧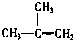
| A. | ①和 ② | B. | ④和⑥ | C. | ⑤和⑦; ④和⑧ | D. | ①和③ |
16.在室温条件下,向含有H2SO4的CuSO4溶液中逐滴加入含a mol溶质的NaOH溶液,恰好使溶液的pH=7,下列叙述正确的是( )
| A. | 溶液中2c(Na+)=c(SO42-) | B. | 0<沉淀的物质的量<$\frac{a}{2}$ mol | ||
| C. | 沉淀的物质的量$\frac{a}{2}$ mol | D. | 原溶液中c(H2SO4)=$\frac{a}{2}$ mol•L-1 |