题目内容
9.(1)根据价层电子对互斥理论判断下列分子或离子中空间构型是V形的是bd(填写序号)a.H3O+ b.H2O c.NO2+ d.NO2-
(2)已知FeCl3的沸点:319℃,熔点:306℃,则FeCl3的晶体类型为分子晶体.P可形成H3PO4、HPO3、H3PO3等多种酸,则这三种酸的酸性由强到弱的顺序为HPO3>H3PO4>H3PO3(用化学式填写)
(3)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2.T的基态原子外围电子(价电子)排布式为3d84s2Q2+的未成对电子数是4.
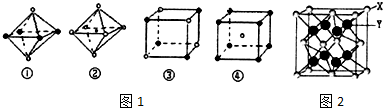
(4)如图1是从NaCl或CsCl晶体结构图中分割出来的部分结构图,判断NaCl晶体结构的图象是图1中的②③.
(5)[Cu(NH3)4]2+配离子中存在的化学键类型有①③(填序号).
①配位键②金属键③极性共价键④非极性共价键⑤离子键⑥氢键,
若[Cu(NH3)4]2+具有对称的空间构型,且当[Cu(NH3)4]2+中的两个NH3被两个Cl-取代时,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为①(填序号)
①平面正方形②正四面体③三角锥形④V形.
(6)X与Y可形成离子化合物,其晶胞结构如图2所示.其中X和Y的相对原子质量分别为a和b,晶体密度为ρg/cm3,则晶胞中距离最近的X、Y之间的核间距离是$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{4a+8b}{ρ{N}_{A}}}$cm(NA表示阿伏伽德罗常数,用含ρ、a、b、NA的代数式表达)
分析 (1)计算中心原子价层电子对数、孤电子对数,进而确定分子构型;
(2)氯化铁熔沸点较低,应为分子晶体;同种元素含氧酸,该元素化合价越高,其酸性越强,非羟基氧越多,酸性越强;
(3)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2,则Q为Fe、T为Ni;
(4)NaCl属于立方晶体,每个钠离子周围有6个氯离子、每个氯离子周围有6个钠离子;
(5)[Cu(NH3)4]2+中铜离子与氮原子之间形成配位键,氨气分子中N原子与H原子之间形成极性键;
[Cu(NH3)4]2+中的两个NH3被两个Cl-取代能得到两种不同结构的产物,[Cu(NH3)4]2+的空间构型为平面正方形;
(6)根据均摊法计算晶胞中X、Y原子数目,进而计算晶胞的质量,根据m=ρV计算晶胞体积,进而计算晶胞棱长x.Y原子与周围4个X原子形成正四面体结构,令Y与X之间的距离为y,则正四面体中心到底面中心的距离为$\frac{y}{3}$,正四面体的高为$\frac{4}{3}$y,正四面体棱长=$\frac{\sqrt{2}x}{2}$,则正四面体侧面的高为$\frac{\sqrt{2}x}{2}$×$\frac{\sqrt{3}}{2}$,底面中心到边的距离为$\frac{\sqrt{2}x}{2}$×$\frac{\sqrt{3}}{2}$×$\frac{1}{3}$,再根据勾股定理进行解答.
解答 解:(1)H3O+中中心原子O的价层电子对数为3+$\frac{6-1-1×3}{2}$=4,孤电子对数为1,所以空间构型是三角锥形;
H2O中中心原子O的价层电子对数为2+$\frac{6-1×2}{2}$=4,孤电子对数为2,所以空间构型是V形;
NO2+中中心原子N的价层电子对数为2+$\frac{5-1-2×2}{2}$=2,孤电子对数为0,所以空间构型是直线形;
NO2-中中心原子N的价层电子对数为2+$\frac{5+1-2×3}{2}$=3,孤电子对数为1,所以空间构型是V形,
故选:bd;
(2)FeCl3的沸点:319℃,熔点:306℃,熔沸点较低,应属于分子晶体;
H3PO4、HPO3、H3PO3中P元素化合价依次为+5、+5、+3,H3PO4、HPO3中非羟基氧依次为1、2,元素化合价越高,其酸性越强,非羟基氧越多,酸性越强,故酸性HPO3>H3PO4>H3PO3,
故答案为:分子晶体;HPO3>H3PO4>H3PO3;
(3)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2,则Q为Fe、T为Ni;
Ni的基态原子外围电子(价电子)排布式为3d84s2,Fe2+的核外电子排布为1s22s22p63s23p63d6,3d能级有4故未成对电子,
故答案为:3d84s2;4;
(4)由于在NaCl晶体中,每个Na+周围同时吸引着最近的等距离的6个Cl-,每个Cl-周围同时吸引着最近的等距离的6个Na+,图②中符合条件,图③中选取其中一个离子,然后沿X、Y、Z三轴切割得到6个等距离的且最近的带相反电荷的离子,所以其配位数也是6,故符合条件,
故选:②③;
(5)[Cu(NH3)4]2+中铜离子与氮原子之间形成配位键,氨气分子中N原子与H原子之间形成极性键;
[Cu(NH3)4]2+中的两个NH3被两个Cl-取代能得到两种不同结构的产物,[Cu(NH3)4]2+的空间构型为平面正方形,
故答案为:①③;①;
(6)晶胞中X原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4、Y原子数目为8,晶胞的质量为$\frac{4a+8b}{{N}_{A}}$g,晶体密度为ρg/cm3,则晶胞体积为为$\frac{4a+8b}{{N}_{A}}$g÷ρg/cm3,故晶胞棱长x=$\root{3}{\frac{4a+8b}{ρ{N}_{A}}}$cm.
Y原子与周围4个X原子形成正四面体结构,令Y与X之间的距离为y,则正四面体中心到底面中心的距离为$\frac{y}{3}$,正四面体的高为$\frac{4}{3}$y,正四面体棱长=$\frac{\sqrt{2}x}{2}$,则正四面体侧面的高为$\frac{\sqrt{2}x}{2}$×$\frac{\sqrt{3}}{2}$,底面中心到边的距离为$\frac{\sqrt{2}x}{2}$×$\frac{\sqrt{3}}{2}$×$\frac{1}{3}$,故($\frac{4}{3}$y)2+($\frac{\sqrt{2}x}{2}$×$\frac{\sqrt{3}}{2}$×$\frac{1}{3}$)2=($\frac{\sqrt{2}x}{2}$×$\frac{\sqrt{3}}{2}$)2,整理得y=$\frac{\sqrt{3}}{4}$x,故Y与X的距离为$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{4a+8b}{ρ{N}_{A}}}$cm,故答案为:$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{4a+8b}{ρ{N}_{A}}}$.
点评 本题是对物质结构的考查,涉及微粒构型判断、晶体类型与性质、核外电子排布、化学键、晶胞结构与晶胞计算,(6)中计算为易错点、难点,需要学生具备一定空间想象能力和数学运算能力,难度较大.

| A. | Na2CO3溶液:c(Na+)>c(CO32-)>c(OH-)>c(H+) | |
| B. | 升高温度,溶液pH减小 | |
| C. | 稀释溶液,溶液中所有离子浓度都减小 | |
| D. | 加入Ba(OH)2固体c(CO32-)增大 |
| A. | NaOH | B. | SiO2 | C. | Fe | D. | H2Se |
| A. | 有机高分子化合物称为聚合物或高聚物,是因为它们大部分是由小分子通过聚合反应而制得的 | |
| B. |  的单体是HOCH2OH与 的单体是HOCH2OH与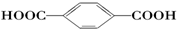 | |
| C. | 聚乙烯( )是由乙烯加聚生成的纯净物 )是由乙烯加聚生成的纯净物 | |
| D. | 高分子材料可分为天然高分子材料和合成高分子材料两大类 |
 H2O
H2O CO2
CO2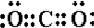 .
. .
. .
.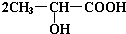 +Na2CO3→
+Na2CO3→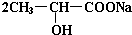 +H2O+CO2↑.
+H2O+CO2↑. .
. 我国菱镁矿资源丰富、质地优良,是优势矿产之一,其主要成分是碳酸镁.某地菱镁矿中还含有较多的脉石(SiO2)和少量石灰石,利用该菱镁矿制备硫酸镁(MgSO4•7H2O),的实验步骤如下:
我国菱镁矿资源丰富、质地优良,是优势矿产之一,其主要成分是碳酸镁.某地菱镁矿中还含有较多的脉石(SiO2)和少量石灰石,利用该菱镁矿制备硫酸镁(MgSO4•7H2O),的实验步骤如下: $\stackrel{氧化}{→}$
$\stackrel{氧化}{→}$ +R3COOH
+R3COOH