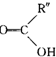
题目内容
17.牛奶放置时间长了会变酸,这是因为牛奶中含有不少乳糖,在微生物的作用下乳糖分解而变成乳酸.乳酸最初就是从酸牛奶中得到并由此而得名的.乳酸又叫2-羟基丙酸.完成下列问题.(1)写出乳酸的结构简式:
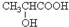 .
.(2)写出乳酸与足量金属钠反应的化学方程式
 .
.(3)写出乳酸与碳酸钠溶液反应的化学方程式:
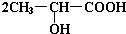 +Na2CO3→
+Na2CO3→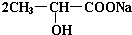 +H2O+CO2↑.
+H2O+CO2↑.(4)乳酸在浓H2SO4作用下,两分子相互反应生成环状结构的物质.写出其生成物的结构简式:
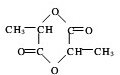 .
.(5)乳酸在浓H2SO4作用下三分子相互反应生成链状结构的物质.写出其生成物的结构简式:HO-C(CH3)-COO-C(CH3)-COO-C(CH3)-COOH.
分析 (1)乳酸又叫2-羟基丙酸,所以乳酸的结构为: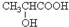 ;
;
(2)-OH、-COOH均与Na反应;
(3)只有-COOH与碳酸钠反应;
(4)两分子相互反应生成为酯环,即分子发生酯化反应;
(5)三分子相互反应生成链状结构的物质,为酯,即分子发生酯化反应.
解答 解:(1)乳酸又叫2-羟基丙酸,所以乳酸的结构为: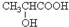 ,故答案为:
,故答案为: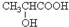 ;
;
(2)金属钠与醇、羧酸都能发生反应,置换出氢气,反应方程式为 ,
,
故答案为: ;
;
(3)羧酸的酸性比碳酸强,碳酸钠能与羧酸反应,不能与醇反应,反应方程式为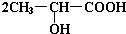 +Na2CO3→
+Na2CO3→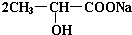 +H2O+CO2↑,
+H2O+CO2↑,
故答案为: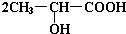 +Na2CO3→
+Na2CO3→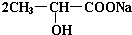 +H2O+CO2↑;
+H2O+CO2↑;
(4)乳酸的结构简式为CH3CH(OH)COOH,2个乳酸分子在一定条件下可发生酯化反应生成六元环状化合物,反应方程式为:2CH3CH(OH)COOH$\stackrel{催化剂}{→}$ +2H2O,故答案为:
+2H2O,故答案为: ;
;
(5)两分子相互反应生成链状结构的物质,为酯,即分子发生酯化反应,该生成物为HO-C(CH3)-COO-C(CH3)-COO-C(CH3)-COOH,
故答案为:HO-C(CH3)-COO-C(CH3)-COO-C(CH3)-COOH.
点评 本题以乳酸的结构为载体,考查官能团的性质,题目难度不大,熟悉常见官能团的性质,进行知识迁移运用即可解答,侧重醇、羧酸性质的考查.

练习册系列答案
 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
8.第三周期元素X、Y、Z、W的最高价氧化物溶于水可得四种溶液,0.010mol•L-1的这四种溶液pH与该元素原子半径的关系如右图所示.下列说法正确的是( )
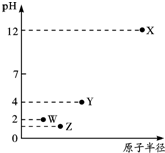

| A. | 简单离子半径:X>Y>Z>W | |
| B. | Y元素存在同素异形体 | |
| C. | 气态氢化物的稳定性:Z>W>Y | |
| D. | X和Y的最高价氧化物对应的水化物恰好中和时,溶液呈中性 |
5.对于100mL1mol/L盐酸与铁片的反应,采取下列措施:①升高温度;②改用100mL3mol/L盐酸;③多用300mL1mol/L盐酸;④用等量铁粉代替铁片;⑤改用98%的硫酸;其中能使反应速率加快的是( )
| A. | ①④⑤ | B. | ①②④ | C. | ②③④ | D. | ②③⑤ |
12.某烃的分子式为C11H20,1mol该烃在催化剂作用下可以吸收2mol H2;用热的酸性KMnO4溶液氧化,得到丁酮( 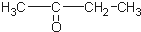 )、丙酮(
)、丙酮(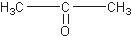 )和琥珀酸(
)和琥珀酸(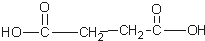 )三者的混合物,该烃的结构简式为( )
)三者的混合物,该烃的结构简式为( )
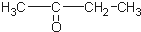 )、丙酮(
)、丙酮( )和琥珀酸(
)和琥珀酸(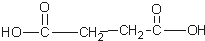 )三者的混合物,该烃的结构简式为( )
)三者的混合物,该烃的结构简式为( )| A. | 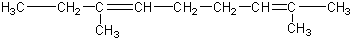 | |
| B. | 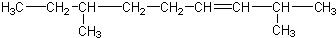 | |
| C. | 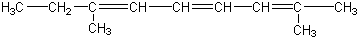 | |
| D. | 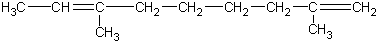 |
2.参照反应Br+H?HBr+H的能量对反应历程的示意图,下列叙述中正确的是( )
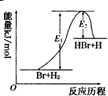

| A. | 该反应的反应热△H=E2-E1 | |
| B. | 加入催化剂,该化学反应的反应热和平衡常数变大 | |
| C. | 正反应的吸热反应 | |
| D. | 升高温度可增大正反应速率,降低逆反应速率 |
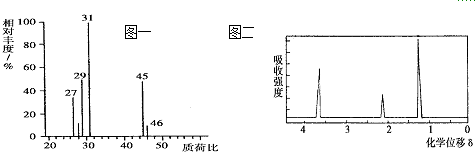
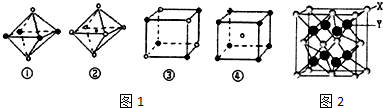
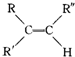 $→_{H_{2}SO_{4}}^{KMnO_{4}}$
$→_{H_{2}SO_{4}}^{KMnO_{4}}$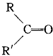 +
+