题目内容
19.已知烃A的分子中碳氢原子个数比为1:2,其相对分子质量为112,A在一定条件下氧化时,由于C=C键断裂,转化为一种产物G,且G不能使石蕊试液变红.已知:
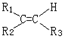 $\stackrel{氧化}{→}$
$\stackrel{氧化}{→}$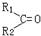 +R3COOH
+R3COOH请回答:
(1)A的分子式为C8H16;
(2)化合物A的一氯代物有3种;
(3)G的结构简式:CH3CH2(CH3)C=O.
分析 (1)烃A的分子中碳氢原子个数比为1:2,设分子式为CnH2n,结合相对分子质量计算出其分子式;
(2)A在一定条件下氧化时,由于C=C键断裂,转化为一种产物G,且G不能使石蕊试液变红,则A具有对称结构,且氧化产物中不含羧基,据此判断其结构简式,然后判断其一氯代物种类;
(3)根据(2)得出的结构简式判断其氧化产物结构.
解答 解:(1)烃A的分子中碳氢原子个数比为1:2,设分子式为CnH2n,则14n=112,解得:n=8,该有机物分子式为:C8H16,
故答案为:C8H16;
(2)A在一定条件下氧化时,由于C=C键断裂,转化为一种产物G,且G不能使石蕊试液变红,根据题干信息反应原理可知,在碳碳双键两端的C上不含H原子,且带有对称结构,则A的结构简式为:CH3CH2(CH3)C=C(CH3)CH2CH3,该有机物分子中含有3种等效H原子,则其一氯代物有3种,
故答案为:3;
(3)根据信息反应原理可知,CH3CH2(CH3)C=C(CH3)CH2CH3被氧化生成产物为:CH3CH2(CH3)C=O,
故答案为:CH3CH2(CH3)C=O.
点评 本题考查了有机物分子式、结构简式的确定,题目难度中等,明确信息反应原理为解答关键,注意掌握常见有机物结构与性质,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.下列说法正确的是( )
| A. | 放热反应一定能自发的进行 | |
| B. | SO2能使品红溶液和溴水褪色,说明SO2具有漂白性 | |
| C. | 将AlCl3溶液和Al2(SO4)3溶液分别蒸干灼烧,所得产物的成分均为Al2O3 | |
| D. | 由反应AgCl(s)+KI(aq)?AgI(s)+KCl(aq)可知Ksp(AgCl)>Ksp(AgI) |
14.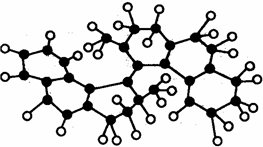 世界上最小的“马达”,只有千万分之一个蚊子那么大,其球棍模型如图(其中小黑球代表碳原子,小白球代表氢原子),它仅有碳氢两种元素组成,将来可用于消除体内垃圾. 该“马达”可能具有的性质是( )
世界上最小的“马达”,只有千万分之一个蚊子那么大,其球棍模型如图(其中小黑球代表碳原子,小白球代表氢原子),它仅有碳氢两种元素组成,将来可用于消除体内垃圾. 该“马达”可能具有的性质是( )
 世界上最小的“马达”,只有千万分之一个蚊子那么大,其球棍模型如图(其中小黑球代表碳原子,小白球代表氢原子),它仅有碳氢两种元素组成,将来可用于消除体内垃圾. 该“马达”可能具有的性质是( )
世界上最小的“马达”,只有千万分之一个蚊子那么大,其球棍模型如图(其中小黑球代表碳原子,小白球代表氢原子),它仅有碳氢两种元素组成,将来可用于消除体内垃圾. 该“马达”可能具有的性质是( )| A. | 溶于水 | B. | 可以燃烧 | ||
| C. | 能和溴水发生取代反应 | D. | 能发生消去反应 |
11.下列说法正确的是( )
| A. | 用核磁共振氢谱不能区分HCOOCH3和HCOOCH2CH3 | |
| B. | 在浓硫酸存在下,苯与浓硝酸共热生成硝基苯的反应属于取代反应 | |
| C. | 用Na2CO3溶液不能区分CH3COOH和CH3COOCH2CH3 | |
| D. | 油脂在酸性或碱性条件下均可发生水解反应,且产物相同 |
8.根据热化学方程式,正确的是( )
(1)CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H1=-Q1 kJ•mol-1
(2)CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H2=-Q2 kJ•mol-1.
(1)CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H1=-Q1 kJ•mol-1
(2)CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H2=-Q2 kJ•mol-1.
| A. | Q1>Q2 | B. | △H1>△H2 | C. | Q1=Q2 | D. | △H1<△H2 |
9.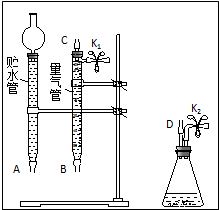 某课外活动小组对“外界条件对铜与稀硝酸反应速率的影响”作了如下探究.
某课外活动小组对“外界条件对铜与稀硝酸反应速率的影响”作了如下探究.
(1)现有以下仪器和用品:橡胶管、秒表、温度计、amol/L稀硝酸、bmol/L稀硝酸及下图中仪器.
①写出本实验的化学方程式,并标出电子转方向和数目: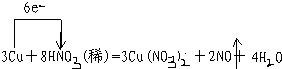 .
.
②设计实验方案:在相同稀硝酸浓度、不同温度(或相同温度、不同稀硝酸浓度)下,测定相同时间内产生气体体积(或产生相同体积的气体所需的时间).
③在答卷的图中将A、B、C、D、几处用橡胶管
以正确方式连接起来,以测定反应所产生气体的
体积(三个容器中的液体和水都已画出).
④测定前,为避免NO被氧化为NO2,要用CO2
排出锥形瓶和橡胶管中的空气:装入铜片、松开K2弹簧夹,从K2处的橡胶管向装置中通入CO2,此时K1处应进行的操作是松开K1弹簧夹,接导管通入澄清石灰水至出现白色浑浊为止.
(2)在K2处注入硝酸发生反应.在给定条件下设计实验探究浓度和温度对化学反应速率的影响:温度25℃、50℃;时间t1、t2、t3;收集气体体积V1、V2.请完成下表:
 某课外活动小组对“外界条件对铜与稀硝酸反应速率的影响”作了如下探究.
某课外活动小组对“外界条件对铜与稀硝酸反应速率的影响”作了如下探究.(1)现有以下仪器和用品:橡胶管、秒表、温度计、amol/L稀硝酸、bmol/L稀硝酸及下图中仪器.
①写出本实验的化学方程式,并标出电子转方向和数目:
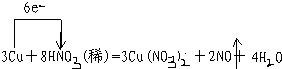 .
.②设计实验方案:在相同稀硝酸浓度、不同温度(或相同温度、不同稀硝酸浓度)下,测定相同时间内产生气体体积(或产生相同体积的气体所需的时间).
③在答卷的图中将A、B、C、D、几处用橡胶管
以正确方式连接起来,以测定反应所产生气体的
体积(三个容器中的液体和水都已画出).
④测定前,为避免NO被氧化为NO2,要用CO2
排出锥形瓶和橡胶管中的空气:装入铜片、松开K2弹簧夹,从K2处的橡胶管向装置中通入CO2,此时K1处应进行的操作是松开K1弹簧夹,接导管通入澄清石灰水至出现白色浑浊为止.
(2)在K2处注入硝酸发生反应.在给定条件下设计实验探究浓度和温度对化学反应速率的影响:温度25℃、50℃;时间t1、t2、t3;收集气体体积V1、V2.请完成下表:
| 实验 编号 | 稀硝酸的浓度/(mol/L) | 稀硝酸的体积/mL | 温度 /℃ | 时间 /min | 收集气体 的体积/mL |
| ① | a | V | 25 | t1 | V1 |
| ② | V | ||||
| ③ | V |
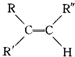 $→_{H_{2}SO_{4}}^{KMnO_{4}}$
$→_{H_{2}SO_{4}}^{KMnO_{4}}$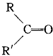 +
+
 .
.