题目内容
14. 我国菱镁矿资源丰富、质地优良,是优势矿产之一,其主要成分是碳酸镁.某地菱镁矿中还含有较多的脉石(SiO2)和少量石灰石,利用该菱镁矿制备硫酸镁(MgSO4•7H2O),的实验步骤如下:
我国菱镁矿资源丰富、质地优良,是优势矿产之一,其主要成分是碳酸镁.某地菱镁矿中还含有较多的脉石(SiO2)和少量石灰石,利用该菱镁矿制备硫酸镁(MgSO4•7H2O),的实验步骤如下:步骤①:将菱镁矿粉碎,加入适量碳酸溶液溶解;
步骤②:过滤,得沉淀B和溶液C;
步骤③:将溶液C蒸发浓缩,趁热过滤,得沉淀D和溶液E;
步骤④:将溶液E蒸发浓缩后冷却结晶,过滤,洗涤,干燥得MgSO4•7H2O.
回答下列问题:
(1)步骤①可在如图所示装置中进行.仪器A的名称是三颈烧瓶.硫酸要分批缓慢加入放热原因是防止硫酸加入过快导致反应中产生大量泡沫使物料从反应器中逸出,矿石要粉碎,反应过程中要不断搅拌的主要目的是防止反应生成的硫酸钙包裹在镁矿石表面导致反应难以进行.
(2)沉淀B的主要成分是SiO2和少量CaSO4(填化学式).
(3)步骤③趁热过滤的目的是防止MgSO4•7H2O析出.
(4)步骤④过滤式需将冷却结晶后的溶液和晶体转移到过滤器中,最后器壁上往往还沾有少量晶体,需选用一种液体将器壁上晶体淋洗并倾入过滤器中,下列液体最合适的是d(填字母).a 冰水 b滤液 c稀硫酸 d无水乙醇.
(5)步骤④不宜采用直接加热法干燥,原因是加热易使MgSO4•7H2O失去结晶水.
(6)测定MgSO4•7H2O的纯度常用滴定法:称取1.0000g试样,用水溶解后转移至100ml容量瓶中,加水至刻度,摇匀.移取25.00ml溶液,置于250ml锥形瓶中,加50ml水、10ml氨-氯化铵缓冲溶液和5滴铬黑T指示剂,用0.05000mol•L-1EDTA标准溶液滴定至溶液由紫红色变为纯蓝色即为终点.已知EDTA与Mg2+以物质的量1:1反应,滴定时消耗EDTA标准溶液体积的平均值为20.02ml,则实验制的MgSO4•7H2O的纯度为99.38%.
分析 (1)根据装置图分析;硫酸与碳酸镁反应很剧烈而且放出大量气体;反应生成的硫酸钙是微溶物质,易包裹在固态表面阻止反应进一步进行;
(2)CaSO4是微溶物质,会形成沉淀;
(3)温度较高时,MgSO4在溶液中溶解度较大;
(4)MgSO4难溶于乙醇,用乙醇洗涤可以减少MgSO4的损失;
(5)晶体受热易分解失去结晶水;
(6)根据消耗的EDTA的量求出镁离子的物质的量,再求出MgSO4•7H2O的质量,根据纯度=$\frac{m(MgS{O}_{4}•7{H}_{2}O)}{m(样品)}$×100%计算.
解答 解:(1)根据装置图可知仪器A为三颈烧瓶;硫酸与碳酸镁反应很剧烈而且放出大量二氧化碳气体,会产生大量的泡沫使物料从反应器中逸出,所以硫酸要分批缓慢加入以降低其反应速率;硫酸与碳酸钙反应生成硫酸钙,硫酸钙是微溶物质,会以沉淀形式析出包裹在镁矿石表面,使镁矿石与硫酸隔离,阻止反应进一步进行;
故答案为:三颈烧瓶;防止硫酸加入过快导致反应中产生大量泡沫使物料从反应器中逸出;防止反应生成的硫酸钙包裹在镁矿石表面导致反应难以进行;
(2)硫酸与碳酸钙反应生成硫酸钙,CaSO4是微溶物质,会形成沉淀,所以沉淀B的主要成分是SiO2和少量CaSO4;
故答案为:CaSO4;
(3)温度较高时,MgSO4在溶液中溶解度较大,所以趁热过滤可以防止MgSO4从溶液中以晶体的形式析出;
故答案为:防止MgSO4•7H2O析出;
(4)MgSO4难溶于乙醇,用乙醇冲洗可以减少MgSO4的损失,而选用冰水、滤液、稀硫酸均能使硫酸镁因为溶解而损失;
故答案为:d;
(5)MgSO4•7H2O受热易分解失去结晶水转化为MgSO4,使得到的硫酸镁晶体的质量减小,所以不能采用直接加热法干燥;
故答案为:加热易使MgSO4•7H2O失去结晶水;
(6)已知EDTA与Mg2+以物质的量1:1反应,滴定时消耗EDTA标准溶液体积的平均值为20.02ml,则EDTA的物质的量为0.0202L×0.05000mol•L-1=1.010×10-3mol,
则n(Mg2+)=1.010×10-3mol,所以n(MgSO4•7H2O)=1.010×10-3mol×$\frac{100}{25}$=4.040×10-3mol,m(MgSO4•7H2O)=4.040×10-3mol×246g/mol=0.9938g,
则MgSO4•7H2O的纯度为:$\frac{m(MgS{O}_{4}•7{H}_{2}O)}{m(样品)}$×100%=$\frac{0.9938g}{1.0000g}$×100%=99.38%;
故答案为:99.38%.
点评 本题考查了物质的制备、分离提纯实验方案的设计,注意把握习题中的信息、物质的性质及混合物分离方法为解答的关键,侧重分析与实验能力、以及计算能力的考查,题目难度中等.

①

②

③
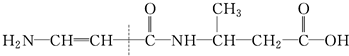
④
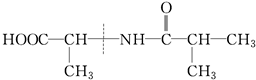
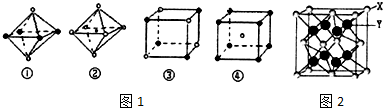
| A. | ①② | B. | ②③④ | C. | ①③ | D. | 全部 |
| A. | ①④⑤ | B. | ①②④ | C. | ②③④ | D. | ②③⑤ |
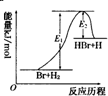
| A. | 该反应的反应热△H=E2-E1 | |
| B. | 加入催化剂,该化学反应的反应热和平衡常数变大 | |
| C. | 正反应的吸热反应 | |
| D. | 升高温度可增大正反应速率,降低逆反应速率 |
(1)
 (2)CH2=CH-CH3 (3)CH3COOCH3(4)CH3-CHO (5)CH3-OH (6)CH3CH2COOH
(2)CH2=CH-CH3 (3)CH3COOCH3(4)CH3-CHO (5)CH3-OH (6)CH3CH2COOH请将它所对应的物质类别填入下列表格中并写出官能团名称
| 物质序号 | 物质类别 | 官能团名称 | 物质序号 | 物质类别 | 官能团名称 |
| (1) | (4) | ||||
| (2) | (5) | ||||
| (3) | (6) |
 在酸性条件下水解生成M和N:
在酸性条件下水解生成M和N: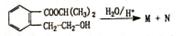
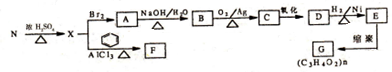
 .
.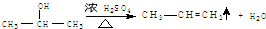 ,E转化为G的化学方程式为
,E转化为G的化学方程式为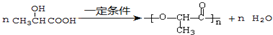 .
.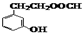 .
.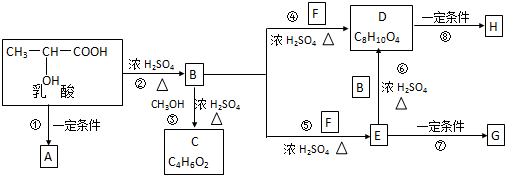
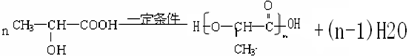 .
.