题目内容
19.1molX与足量Y在一定条件下充分反应,可生成0.5mol气体的是( )| 选项 | X | Y |
| A | Al | NaOH溶液 |
| B | NO2 | H2O |
| C | Na2O2 | CO2 |
| D | Fe | H2O(g) |
| A. | A | B. | B | C. | C | D. | D |
分析 A、2Al+2NaOH+2H2O=2NaAlO2+3H2↑由方程式可以看出,反应关系式为2Al~3H2↑,分析求解;
B、3NO2+H2O═2HNO3+NO,根据化学方程式求解;
C、2Na2O2+2CO2=2Na2CO3+O2,根据化学方程式求解;
D、3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,根据化学方程式求解.
解答 解:A、2Al+2NaOH+2H2O=2NaAlO2+3H2↑由方程式可以看出,反应关系式为2Al~3H2↑,1mol的铝生成1.5mol的氢气,故A错误;
B、3NO2+H2O═2HNO3+NO,1mol的二氧化氮生成$\frac{1}{3}$mol的一氧化氮,故B错误;
C、2Na2O2+2CO2=2Na2CO3+O2,1mol的二氧化碳生成0.5mol的氧气,故C正确;
D、3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,根1mol的水蒸气生成1mol的氢气,故D错误;
故选C.
点评 本题考查学生根据化学方程进行计算,学生应清楚各物质之间的转化关系,然后分析解答,比较容易.

练习册系列答案
相关题目
17.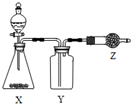 如图是用于制取、收集并吸收多余气体的装置,如表方案正确的是( )
如图是用于制取、收集并吸收多余气体的装置,如表方案正确的是( )
 如图是用于制取、收集并吸收多余气体的装置,如表方案正确的是( )
如图是用于制取、收集并吸收多余气体的装置,如表方案正确的是( )| 选项 | X | Y | Z |
| A | 食盐、浓硫酸 | HCl | 碱石灰 |
| B | CaO、浓氨水 | NH3 | 无水CaCl2 |
| C | Cu、浓硝酸 | NO2 | 碱石灰 |
| D | 电石、食盐水 | C2H2 | 含溴水的棉花 |
| A. | A | B. | B | C. | C | D. | D |
14.下列关于有机物的叙述错误的是( )
| A. | 石油气、煤油和石蜡的主要成分都是碳氢化合物 | |
| B. | 含碳的化合物不一定都是有机物 | |
| C. | 由CH2=CH-COOCH3合成的聚合物为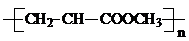 | |
| D. | 苯不具有典型双键所应具有的加成反应,故不可能发生加成反应 |
4.下列有机物水解时,断键位置不正确的是( )
①
②
③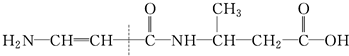
④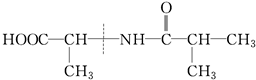
①

②

③
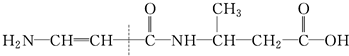
④

| A. | ①② | B. | ②③④ | C. | ①③ | D. | 全部 |
11.下列关于同分异构体判断正确的是( )
| A. | 分子式为C2H6O的同分异构体有两个,分别是CH3OCH3和CH3CH2OH | |
| B. | 分子式为C8H10的芳香烃有3种,分别为 、 、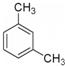 、 、 | |
| C. | 分子式为C4H8的烯烃同分异构体有2个,分别为CH2=CHCH2CH3、CH3CH=CHCH3 | |
| D. | 二氯甲烷是正四面体结构, 和 和 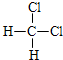 是同一种物质 是同一种物质 |
8.第三周期元素X、Y、Z、W的最高价氧化物溶于水可得四种溶液,0.010mol•L-1的这四种溶液pH与该元素原子半径的关系如右图所示.下列说法正确的是( )
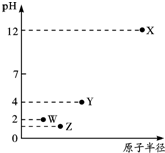

| A. | 简单离子半径:X>Y>Z>W | |
| B. | Y元素存在同素异形体 | |
| C. | 气态氢化物的稳定性:Z>W>Y | |
| D. | X和Y的最高价氧化物对应的水化物恰好中和时,溶液呈中性 |
 某温度,将2molCO与5molH2的混合气体充入容积为2L的密闭容器中,在催化剂的作用下发生反应:CO(g)+2H2(g)?CH3OH(g).经过5min后,反应达到平衡,此时转移电子6mol.
某温度,将2molCO与5molH2的混合气体充入容积为2L的密闭容器中,在催化剂的作用下发生反应:CO(g)+2H2(g)?CH3OH(g).经过5min后,反应达到平衡,此时转移电子6mol.