题目内容
4.在一定条件下Na2CO3溶液存在水解平衡:CO32-+H2O?HCO3-+OH-.下列说法正确的是( )| A. | Na2CO3溶液:c(Na+)>c(CO32-)>c(OH-)>c(H+) | |
| B. | 升高温度,溶液pH减小 | |
| C. | 稀释溶液,溶液中所有离子浓度都减小 | |
| D. | 加入Ba(OH)2固体c(CO32-)增大 |
分析 A、碳酸钠溶液中,碳酸根离子部分水解,溶液显示碱性,则c(OH-)>c(H+),根据电荷守恒判断溶液中离子浓度大小;
B、水解反应是吸热反应,升温促进碳酸钠的水解;
C、稀释溶液平衡状态下的各微粒浓度减小,溶液中存在离子积常数,氢氧根离子浓度减小,氢离子浓度增大;
D、加入氢氧化钡固体溶解后,钡离子和碳酸根离子结合生成碳酸钡沉淀,溶液中碳酸根离子浓度减小.
解答 解:A、在一定条件下Na2CO3溶液存在水解平衡:CO32-+H2O?HCO3-+OH-,溶液显碱性,离子浓度大小为:c(Na+)>c(CO32-)>c(OH-)>c(H+),故A正确;
B、水解反应是吸热反应,升温可以促进水解平衡正向进行,氢氧根离子浓度增大,氢离子浓度减小,溶液PH增大,故B错误;
C、稀释溶液除氢离子外的其他离子浓度减小,溶液中存在离子积常数,氢氧根离子浓度减小,氢离子浓度增大,故C错误;
D、加入氢氧化钡固体溶解后,溶液中钡离子和碳酸根离子结合生成碳酸钡沉淀,溶液中碳酸根离子浓度减小,故D错误;
故选A.
点评 本题考查了盐类水解的分析判断,主要是溶液中离子浓度大小比较,影响水解平衡的因素分析判断,掌握平衡移动原理是解题关键,题目较简单.

练习册系列答案
相关题目
14.下列关于有机物的叙述错误的是( )
| A. | 石油气、煤油和石蜡的主要成分都是碳氢化合物 | |
| B. | 含碳的化合物不一定都是有机物 | |
| C. | 由CH2=CH-COOCH3合成的聚合物为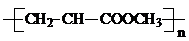 | |
| D. | 苯不具有典型双键所应具有的加成反应,故不可能发生加成反应 |
15.已知298K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=13,则下列说法不正确的是( )
| A. | 所得溶液中的c(H+)=1.0×10-13 mol•L-1 | |
| B. | 所得溶液中由水电离产生的c(OH-)=1.0×10-13 mol•L-1 | |
| C. | 所加的烧碱溶液的pH=13.0 | |
| D. | 所得溶液中的c(Mg2+)=5.6×10-10 mol•L-1 |
12.某烃的分子式为C11H20,1mol该烃在催化剂作用下可以吸收2mol H2;用热的酸性KMnO4溶液氧化,得到丁酮( 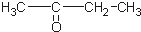 )、丙酮(
)、丙酮(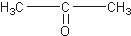 )和琥珀酸(
)和琥珀酸( )三者的混合物,该烃的结构简式为( )
)三者的混合物,该烃的结构简式为( )
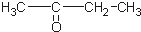 )、丙酮(
)、丙酮( )和琥珀酸(
)和琥珀酸( )三者的混合物,该烃的结构简式为( )
)三者的混合物,该烃的结构简式为( )| A. | 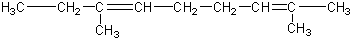 | |
| B. | 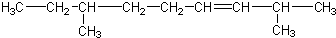 | |
| C. | 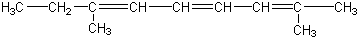 | |
| D. |  |
19.能够鉴定溴乙烷中溴元素的存在的操作是( )
| A. | 在溴乙烷中直接加入AgNO3溶液 | |
| B. | 在溴乙烷中加蒸馏水,然后加入AgNO3溶液 | |
| C. | 在溴乙烷中加入NaOH溶液,加热后酸化,然后加入AgNO3溶液 | |
| D. | 在溴乙烷中加入乙醇加热后,然后加入AgNO3溶液 |
16.下列说法正确的是( )
| A. | C5H12的同分异构体数目与甲苯(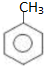 )一氯代物的数目相同 )一氯代物的数目相同 | |
| B. | CH2═CH2+H20$\stackrel{一定条件}{→}$ CH3CH2OH 属于还原反应 | |
| C. | C3H6Cl2有4种同分异构体(不考虑立体异构) | |
| D. | 石油分馏和煤的干馏均属于物理变化 |
13.下列关于元素周期律的叙述正确的是( )
| A. | 随着元素原子序数的递增,原子最外层电子总是从1到8重复出现 | |
| B. | 随着元素原子序数的递增,元素最高正价从+1到+7、负价从-7到-1重复出现 | |
| C. | 随着元素原子序数的递增,原子半径从小到大(稀有气体除外)发生周期性变化 | |
| D. | 元素原子的核外电子排布、原子半径及元素主要化合价的都发生周期性变化 |
14.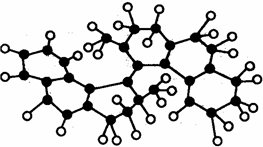 世界上最小的“马达”,只有千万分之一个蚊子那么大,其球棍模型如图(其中小黑球代表碳原子,小白球代表氢原子),它仅有碳氢两种元素组成,将来可用于消除体内垃圾. 该“马达”可能具有的性质是( )
世界上最小的“马达”,只有千万分之一个蚊子那么大,其球棍模型如图(其中小黑球代表碳原子,小白球代表氢原子),它仅有碳氢两种元素组成,将来可用于消除体内垃圾. 该“马达”可能具有的性质是( )
 世界上最小的“马达”,只有千万分之一个蚊子那么大,其球棍模型如图(其中小黑球代表碳原子,小白球代表氢原子),它仅有碳氢两种元素组成,将来可用于消除体内垃圾. 该“马达”可能具有的性质是( )
世界上最小的“马达”,只有千万分之一个蚊子那么大,其球棍模型如图(其中小黑球代表碳原子,小白球代表氢原子),它仅有碳氢两种元素组成,将来可用于消除体内垃圾. 该“马达”可能具有的性质是( )| A. | 溶于水 | B. | 可以燃烧 | ||
| C. | 能和溴水发生取代反应 | D. | 能发生消去反应 |