题目内容
原子序数在3~9之间的元素,随着核电荷数的递增而逐渐增大的是
| A.电子层数 | B.最外层电子数 | C.原子半径 | D.化合价 |
B
解析试题分析:原子序数在3~9之间的元素均是第二周期的元素,随着核电荷数的递增而逐渐增大的是最外层电子数,而电子层数不变,原子半径逐渐减小,元素的正化合价逐渐升高,但F没有正价,氧元素没有最高价,所以B正确,A、C、D均是错误的,答案选B。
考点:考查元素周期律的应用与的

练习册系列答案
相关题目
离子化合物A2B3是由短周期元素A和B形成,已知A3+离子比B2-离子少一个电子层,以下推断正确的是
| A.化合物A2B3是氧化铝 |
| B.A3+和B2-最外电子层上的电子数都是8 |
| C.A的最高价氧化物对应的水化物是强电解质 |
| D.元素B是第2周期第VIA族的元素 |
下列选项的说法中正确的是
| A.1s22s12p1表示的是激发态原子的电子排布 |
| B.3p2表示3p能级有两个原子轨道 |
| C.同一原子中,1s、2s、3s电子的能量逐渐减小 |
| D.同一原子中,2p、3p、4p能级的轨道数依次增多 |
下表是第三周期部分元素的电离能[单位:eV(电子伏特)]数据。
| 元素 | I1/eV | I2/eV | I3/eV[ |
| 甲 | 5.7 | 47.4 | 71.8 |
| 乙 | 7.7 | 15.1 | 80.3 |
| 丙 | 13.0 | 23.9 | 40.0 |
| 丁 | 15.7 | 27.6 | 40.7 |
根据以上数据分析,下列说法正确的是
A.甲的金属性比乙弱 B.乙的化合价为+1价
C.丙一定为非金属元素 D.丁一定为金属元素
某元素的一个原子形成的离子可表示为 ,下列说法正确的是
,下列说法正确的是
A. 含有的中子数为a+b 含有的中子数为a+b | B. 含有的电子数为a-n 含有的电子数为a-n |
| C.X原子的质量数为a+b+n | D.X原子的质量约为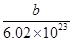 g g |
短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态氢化物的水溶液呈碱性,乙位于第VA族,甲和丙同主族,丁的最外层电子数和电子层数相等,则下列说法中正确的是 ( )
| A.原子半径:丙>乙>丁 |
| B.单质的还原性:丁>丙>甲 |
| C.甲、乙、丙的氧化物均为共价化合物 |
| D.乙、丙、丁的最高价氧化物对应的水化物能相互反应 |
短周期元素X、Y、Z、W、Q在周期表中的相对位置如图所示。下列说法不正确的是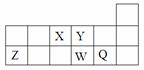
| A.离子半径的大小顺序为W>Q>Y>Z |
| B.X、Y、W三种元素的电负性大小顺序为X>Y>W |
| C.X、Z、W三种元素的最高价氧化物对应的水化物均能与强碱反应 |
| D.元素X的最简单氢化物与Q的氢化物化合的产物中既含共价键又含离子键 |
短周期元素X、Y、Z、W 的原子序数依次增大,且原子最外层电子数之和为13,X 的原子半径比Y 的小,X 与W 同主族,Z 是地壳中含量最高的元素。下列说法正确的是 ( )
| A.由X与Y组成的化合物的沸点总低于由X与Z组成的化合物的沸点 |
| B.元素Z、W 的简单离子的电子层结构不同 |
| C.元素Y 的简单气态氢化物的热稳定性比Z 的强 |
| D.只含X、Y、Z 三种元素的化合物,可能是离子化合物,也可能是共价化合物 |