题目内容
离子化合物A2B3是由短周期元素A和B形成,已知A3+离子比B2-离子少一个电子层,以下推断正确的是
| A.化合物A2B3是氧化铝 |
| B.A3+和B2-最外电子层上的电子数都是8 |
| C.A的最高价氧化物对应的水化物是强电解质 |
| D.元素B是第2周期第VIA族的元素 |
B
解析试题分析:由两种短周期元素A和M形成的离子化合物A2M3,A3+离子比M2-离子少一个电子层,则A和M都属于第三周期,且A3+具有与Ne原子相同的核外电子层结构,则A是Al元素,M是S元素,A.根据以上分析知化合物A2M3是Al2S3,故A错误;B.铝离子的结构示意图为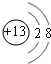 ,硫离子的结构示意图为
,硫离子的结构示意图为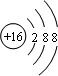 ,故B正确;C.A的最高价氧化物的水化物是Al(OH)3,氢氧化铝是弱电解质,故C错误;D.M是S元素,其原子结构示意图为
,故B正确;C.A的最高价氧化物的水化物是Al(OH)3,氢氧化铝是弱电解质,故C错误;D.M是S元素,其原子结构示意图为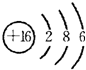 ,电子层数等于其周期数,最外层电子数等于与其族序数相等,所以S元素位于第三周期第VIA族,故D错误;故选B。
,电子层数等于其周期数,最外层电子数等于与其族序数相等,所以S元素位于第三周期第VIA族,故D错误;故选B。
考点:本题考查了元素位置、结构、性质的相互关系及应用,正确推断元素是解本题关键,结合原子、离子的结构来分析解答。

练习册系列答案
相关题目
如图表示1~18号元素原子的结构或性质随核电荷数递增的变化。图中纵坐标表示
| A.电子层数 | B.原子半径 | C.最高化合价 | D.最外层电子数 |
六种短周期元素(a、b、c、d、e、f)的原子序数依次增大。其中a与e同主族,b与f同主族,e与f同周期;常温下a、e的单质状态不同;d的核电荷数是b的最外层电子数的2倍;单质f是一种重要的半导体材料。由此可推知
| A.a、c两种元素只能组成化学式为ca3的化合物 |
| B.b、c、d分别与a形成的化合物,沸点由高到低依次为:d>c>b |
| C.原子半径由大到小的顺序是 e>f>b>c>a |
| D.元素的非金属性由强到弱的顺序是 d>c>f>b |
铟产业被称为“信息时代的朝阳产业”。元素周期表中铟的数据见下图,下列说法完全正确的是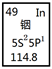
| A.铟元素的质量数是114.8 |
| B.铟元素的相对原子质量是114 |
| C.铟元素是一种主族元素 |
| D.铟原子最外层有3个能量相同的电子 |
元素周期表和元素周期律可以指导人们进行规律性的推测和判断。下列说法不合理的是( )
| A.若X+和Y2-的核外电子层结构相同,则原子序数:X > Y |
| B.由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S |
| C.硅、锗都位于金属与非金属的交界处,都可以做半导体材料 |
| D.Cs和Ba分别位于第六周期IA和IIA族,碱性:CsOH >Ba(OH)2 |
原子序数在3~9之间的元素,随着核电荷数的递增而逐渐增大的是
| A.电子层数 | B.最外层电子数 | C.原子半径 | D.化合价 |
下列判断中一定正确的是( )
| A.若X、Y属于同主族元素,且相对原子质量:X>Y,则X失电子能力比Y强 |
B.若M+和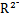 的核外电子层结构相同,则原子半径:R>M 的核外电子层结构相同,则原子半径:R>M |
| C.若X、Y都是气态氢化物,且相对分子质量:X>Y,则酸性:X>Y |
| D.若X、Y是同主族元素,且原子序数:X>Y,则非金属性:X>Y |
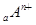 、
、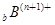 、
、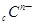 、
、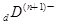 电子层结构相同。关于A、B、C、D四种元素叙述正确的是
电子层结构相同。关于A、B、C、D四种元素叙述正确的是