题目内容
20. 某学校设计了一节实验活动课,让学生从废旧的锌锰酸性干电池中回收碳棒、MnO2、NH4Cl、ZnCl2等物质,整个实验过程如下,请回答有关问题:
某学校设计了一节实验活动课,让学生从废旧的锌锰酸性干电池中回收碳棒、MnO2、NH4Cl、ZnCl2等物质,整个实验过程如下,请回答有关问题:Ⅰ、锌皮和碳棒的回收
用钳子和剪刀剪开回收的干电池的锌筒,将锌皮和碳棒取出,并用毛刷刷干净,将电池内的黑色粉末移入小烧杯中.
Ⅱ、氯化铵、氯化锌的提取、检验和分离.
(1)①从黑色粉末中得到NH4Cl和ZnCl2固体混合物,在以下分离操作中选择恰当的方法(按操作顺序填写序号)aed.
a.溶解 b.分液 c.萃取 d.结晶 e.过滤 f.升华
②用加热法可将NH4Cl和ZnCl2的晶体混合物分离,实验原理用化学方程式表示为NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+HCl↑.
(2)简述检验溶液中含NH4+的实验方法取适量待检液,滴入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体,若试纸变蓝,则证明溶液中含NH4+.
(3)锌锰干电池工作时实现的能量转化形式为化学能转化为电能,负极反应式为Zn-2e═Zn2+.
分析 (1)①从黑色粉末中得到NH4Cl和ZnCl2固体混合物,黑色粉末中碳棒、MnO2均不溶于水,NH4Cl和ZnCl2均溶于水;
②氯化铵固体加热易分解,且遇冷化合生成氯化铵;
(2)利用与碱加热生成气体,气体使湿润的红色石蕊试纸变蓝检验;
(3)电池工作时化学能转化为电能,锌锰干电池中Zn为负极,负极失去电子.
解答 解:(1)①从黑色粉末中得到NH4Cl和ZnCl2固体混合物,黑色粉末中碳棒、MnO2均不溶于水,NH4Cl和ZnCl2均溶于水,则溶解、过滤、结晶可得到NH4Cl和ZnCl2固体混合物,故答案为:aed;
②氯化铵固体加热易分解,且遇冷化合生成氯化铵,则利用加热法将NH4Cl和ZnCl2的晶体混合物分离,发生的反应为NH4Cl $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+HCl↑,
故答案为:加热;NH4Cl $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+HCl↑;
(2)检验溶液中含NH4+的实验方法为取适量待检液,滴入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体,若试纸变蓝,则证明溶液中含NH4+,
故答案为:取适量待检液,滴入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体,若试纸变蓝,则证明溶液中含NH4+;
(3)锌锰干电池工作时实现的能量转化形式为化学能转化为电能,负极反应式为Zn-2e═Zn2+,故答案为:化学能转化为电能;Zn-2e═Zn2+.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、混合物分离方法及原电池原理为解答的关键,侧重分析与应用能力的考查,注意元素化合物性质与反应原理的结合,题目难度不大.

练习册系列答案
相关题目
10.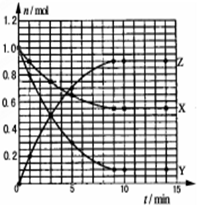 某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如图所示,则下列说法错误的是( )
某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如图所示,则下列说法错误的是( )
 某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如图所示,则下列说法错误的是( )
某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如图所示,则下列说法错误的是( )| A. | 反应的化学方程式是X+2Y?2Z | |
| B. | 该反应在0-3min时间内产物Z的平均反应速率0.083mol•L-1•min-1 | |
| C. | 由图象知该反应吸收能量 | |
| D. | 其他条件不变,升高温度,若正反应速率增大,则逆反应速率将减小 |
11.25℃时,浓度均为为0.1mol/L的HA溶液和BOH溶液,pH分别是1和11,下列说法正确的( )
| A. | BOH溶于水,其电离方程式是BOH═B++OH- | |
| B. | 若将一定量的上述溶液混合后pH=7,则c(A- )=c(B+) | |
| C. | 在0.1 mol/L BA溶液中,c(B+)>c(A- )>c(OH- )>c(H+) | |
| D. | 若将0.1 mol/L BOH溶液稀释至0.001 mol/L,则溶液的pH=9 |
8.下列措施能减慢化学反应速率的是( )
| A. | 将煤块粉碎后燃烧 | |
| B. | 用粗锌替代纯锌与同浓度同体积的盐酸反应制氢气 | |
| C. | 将食物贮藏在冰箱中 | |
| D. | 用双氧水溶液制氧气时添加少量二氧化锰粉末 |
15.氢化铵(NH4H)与氯化铵的结构相似,又知NH4H与水反应有H2生成,该反应可写成NH4H+H2O=NH3•H2O+H2↑.下列说法错误的是( )
| A. | NH4H是离子化合物 | |
| B. | NH4H溶于水形成的溶液呈碱性 | |
| C. | NH4H与水反应时,NH4H是氧化剂 | |
| D. | NH4H固体投入少量水中,可能有两种气体产生 |
5.下列命名正确的是( )
| A. | CH3OCH3:二甲醚 | B. |  :3-乙基-4-戊烯 :3-乙基-4-戊烯 | ||
| C. |  :三甲苯 :三甲苯 | D. |  :3,3,5,5-四甲基己烷 :3,3,5,5-四甲基己烷 |
9.以下反应中,△H1>△H2 的是( )
| A. | S(s)+O2(g)→SO2(g)△H1 S(g)+O2(g)→SO2(g)△H2 | |
| B. | 2H2(g)+O2(g)→2H2O(l)△H 1 2H2(g)+O2(g)→2H2O(g)△H2 | |
| C. | NaOH(aq)+HCl(aq)→NaCl(aq)+H2O(l)△H1 NaOH(aq)+CH3COOH(aq)→CH3COONa(aq)+H2O(l)△H2 | |
| D. | H2(g)+F2(g)→2HF(g)△H1 H2(g)+Cl2(g)→2HCl(g)△H2 |
10.常温下,下列溶液中的离子浓度关系一定正确的是( )
| A. | PH=11的Na2SO3溶液中,水的电离c( H+)=1.0×10-11mol/L | |
| B. | PH=10的某BOH的碱溶液中加水稀释至100倍,稀释后的溶液中c( OH-)=1.0×10-6mol/L | |
| C. | PH=4的NaHC2O4溶液中存在:c( Na+)>c(HC2O4-)>c( H+)>c(C2O42-)>c( OH-) | |
| D. | PH=2的硝酸与PH=12的氨水等体积混合c( NO3-)>c( NH4+)>c( H+)>c( OH-) |
 ⑤-CHO.
⑤-CHO.