题目内容
10.常温下,下列溶液中的离子浓度关系一定正确的是( )| A. | PH=11的Na2SO3溶液中,水的电离c( H+)=1.0×10-11mol/L | |
| B. | PH=10的某BOH的碱溶液中加水稀释至100倍,稀释后的溶液中c( OH-)=1.0×10-6mol/L | |
| C. | PH=4的NaHC2O4溶液中存在:c( Na+)>c(HC2O4-)>c( H+)>c(C2O42-)>c( OH-) | |
| D. | PH=2的硝酸与PH=12的氨水等体积混合c( NO3-)>c( NH4+)>c( H+)>c( OH-) |
分析 A.亚硫酸钠溶液中,亚硫酸根离子的水解促进了水的电离,溶液中的氢氧根离子是水电离的;
B.碱溶液稀释后,溶液中氢氧根离子只能接近1.0×10-7mol/L;
C.pH=4的NaHC2O4溶液,说明HC2O4-的电离程度大于其水解程度,由于氢离子来自水和HC2O4-的电离,则c( H+)>c(C2O42-);
D.一水合氨为弱碱,混合液中氨水过量,溶液显示碱性,则c( OH-)>c( H+)、c( NH4+)>c( NO3-).
解答 解:A.pH=11的Na2SO3溶液中,亚硫酸根离子的水解促进了水的电离,则水的电离c(H+)=1.0×10-3mol/L,故A错误;
B.pH=10的某BOH的碱溶液中加水稀释至100倍,稀释后的溶液中c(OH-)只能无限接近1.0×10-7mol/L,不可能稀释后变成酸溶液,故B错误;
C.NaHC2O4溶液的pH=4,说明HC2O4-的电离程度大于其水解程度,由于氢离子来自水和HC2O4-的电离,则c( H+)>c(C2O42-),溶液中离子浓度大小为:c( Na+)>c(HC2O4-)>c( H+)>c(C2O42-)>c( OH-),故C正确;
D.pH=2的硝酸与pH=12的氨水等体积混合,一水合氨为弱碱,则混合液显示碱性:c( OH-)>c( H+),根据电荷守恒可得:c( NH4+)>c( NO3-),溶液中离子浓度大小为:c( NH4+)>c( NO3-)>c( OH-)>c( H+),故D错误;
故选C.
点评 本题考查了离子浓度大小比较,题目难度中等,明确电荷守恒、物料守恒及盐的水解原理的含义为解答关键,D为易错点,注意氨水为弱碱,混合液中氨水过量,溶液呈碱性,试题侧重考查学生的分析能力及灵活应用基础知识的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.能发生银镜反应,并与丙酸互为同分异构体的物质是( )
| A. | 丙醛 | B. | 甲酸乙酯 | C. | 乙酸甲酯 | D. | 丙烯酸 |
18.研究化学反应原理对于生产、生活及环境保护具有重要意义.已知:
Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=+64.39kJ•mol-1
2H2O2(l)═2H2O(l)+O2(g)△H=-196.46kJ•mol-1
H2(g)+12O2(g)═H2O(l)△H=-285.84kJ•mol-1
则H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的△H为( )
Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=+64.39kJ•mol-1
2H2O2(l)═2H2O(l)+O2(g)△H=-196.46kJ•mol-1
H2(g)+12O2(g)═H2O(l)△H=-285.84kJ•mol-1
则H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的△H为( )
| A. | +319.68kJ•mol-1 | B. | +259.7kJ•mol-1 | C. | -319.68kJ•mol-1 | D. | -259.7kJ•mol-1 |
5.X、Y为同主族元素,Y的原子半径大于X.下列说法正确的是(m、n均为正整数)( )
| A. | 若X(OH)n为强碱,则Y(OH)n也一定为强碱 | |
| B. | 若HnXOm为强酸,则X的氢化物溶于水一定显酸性 | |
| C. | 若HnY为气态,则HnX的熔、沸点一定比HnY低 | |
| D. | 若Y的最高正价为+7,则X的最高正价一定为+7 |
15.2011年3月日本福岛大地震引起的核泄漏污染物中包含13153I等放射性同位素.下列有关13153I的说法中,正确的是( )
| A. | 质子数为53 | B. | 中子数为53 | C. | 质子数为131 | D. | 中子数为131 |
2.下列各反应中,符合如图所示能量变化的是( )


| A. | 金属钠与水的反应 | B. | 氢氧化钡晶体与氯化铵混合反应 | ||
| C. | 氧化钙与水的反应 | D. | 酒精燃烧 |
19.工业焊接钢管常用55137Cs进行“无损探伤”.下列有关说法正确的是( )
| A. | 137表示质量数 | B. | 137表示中子数 | ||
| C. | 该原子质子数大于中子数 | D. | 该原子的K、L层共容纳了10个电子 |
20.下列叙述中,不能用平衡移动原理解释的是( )
| A. | 红棕色的NO2,加压后颜色先变深后变浅 | |
| B. | 高压比常压有利于合成SO3的反应 | |
| C. | 由H2(g)、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 | |
| D. | 黄绿色的氯水光照后颜色变浅 |
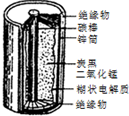 某学校设计了一节实验活动课,让学生从废旧的锌锰酸性干电池中回收碳棒、MnO2、NH4Cl、ZnCl2等物质,整个实验过程如下,请回答有关问题:
某学校设计了一节实验活动课,让学生从废旧的锌锰酸性干电池中回收碳棒、MnO2、NH4Cl、ZnCl2等物质,整个实验过程如下,请回答有关问题: