题目内容
8.下列措施能减慢化学反应速率的是( )| A. | 将煤块粉碎后燃烧 | |
| B. | 用粗锌替代纯锌与同浓度同体积的盐酸反应制氢气 | |
| C. | 将食物贮藏在冰箱中 | |
| D. | 用双氧水溶液制氧气时添加少量二氧化锰粉末 |
分析 根据温度、浓度、催化剂、接触面积对反应速率的影响可知,降低温度,反应速率减慢,而增大接触面、使用催化剂、增大浓度加快反应速率.
解答 解:A.将煤块粉碎后燃烧,固体表面积增大,反应速率增大,故A不选;
B.粗锌替代纯锌,可形成原电池反应,反应速率增大,故B不选.
C.将食物贮藏在冰箱中,温度降低,反应速率减小,故C选;
D.加入催化剂,降低反应的活化能,反应速率增大,故D不选;
故选C.
点评 本题考查化学反应速率的影响,侧重于学生的分析能力和基本理论知识的综合理解和运用的考查,注意把握影响化学反应速率的影响和影响原因,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
3.已知Ksp(AB2)=4.2×10-8,Ksp(AC)=3.0×10-15,在存在AB2、AC固定的饱和的混合溶液中,测得c(C2-)=1.8×10-13 mol/L,则下列说法正确的是( )
| A. | 溶液中c(B-)为1.6×10-3mol/L | |
| B. | 溶液中c(B-)为1.7×10-13mol/L | |
| C. | AB2比AC更难溶解 | |
| D. | 因两者不同类而无法比较其溶解度的大小 |
16.将2mol SO2和1mol O2充入一容积固定的密闭容器中,在一定条件下反应:2SO2(g)+O2(g)2SO3(g),下列哪些情况能说明化学反应已达反应限度的是( )
| A. | 混合气体的压强不再变化 | |
| B. | 混合气体的总质量不再变化 | |
| C. | 每生成2mol SO3的同时,消耗1mol SO2 | |
| D. | 每生成2mol SO2的同时,消耗2mol SO3 |
13.下列反应中,符合如图所示能量变化的是( )
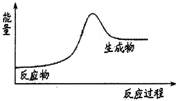

| A. | H2在Cl2中燃烧 | B. | 石灰石分解 | ||
| C. | Na和H2O的反应 | D. | Ba(OH)2•8H2O和NH4Cl固体的反应 |
18.研究化学反应原理对于生产、生活及环境保护具有重要意义.已知:
Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=+64.39kJ•mol-1
2H2O2(l)═2H2O(l)+O2(g)△H=-196.46kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.84kJ•mol-1
则H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的△H为( )
Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=+64.39kJ•mol-1
2H2O2(l)═2H2O(l)+O2(g)△H=-196.46kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.84kJ•mol-1
则H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的△H为( )
| A. | +319.68kJ•mol-1 | B. | +259.7kJ•mol-1 | C. | -319.68kJ•mol-1 | D. | -259.7kJ•mol-1 |
 锰及其化合物应用越来越广泛,MnO2是一种重要的无机功能材料,制备MnO2的方法之一是以石墨为电极,电解酸化的MnSO4溶液,阳极的电极反应式为Mn2+-2e-+2H20=MnO2+4H+.
锰及其化合物应用越来越广泛,MnO2是一种重要的无机功能材料,制备MnO2的方法之一是以石墨为电极,电解酸化的MnSO4溶液,阳极的电极反应式为Mn2+-2e-+2H20=MnO2+4H+.
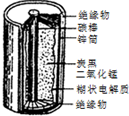 某学校设计了一节实验活动课,让学生从废旧的锌锰酸性干电池中回收碳棒、MnO2、NH4Cl、ZnCl2等物质,整个实验过程如下,请回答有关问题:
某学校设计了一节实验活动课,让学生从废旧的锌锰酸性干电池中回收碳棒、MnO2、NH4Cl、ZnCl2等物质,整个实验过程如下,请回答有关问题: