题目内容
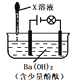
【题目】滴有酚酞的Ba(OH)2溶液显红色,在上述溶液中分别滴加X溶液后有下列现象。下列说法不正确的是
序号 | 装置 | X溶液 | 现象 |
I |
| 盐酸 | 溶液红色褪去,无沉淀,灯泡亮度没有明显变化 |
II | Na2SO4 | 溶液红色不变,有白色沉淀生成,灯泡亮度没有明显变化 | |
III | H2SO4 | 溶液红色褪去,有白色沉淀生成,灯泡逐渐变暗 |
A. 实验I中溶液红色褪去,说明发生了反应H+ + OH- =H2O
B. 实验II中溶液红色不变,且灯泡亮度没有明显变化,说明溶液中依然存在有大量的Na+与OH-
C. 实验III中溶液红色褪去,有白色沉淀生成,灯泡逐渐变暗,说明发生了反应Ba2+ + 2OH- + 2H+ + SO42- == BaSO4↓+ 2H2O
D. 将实验II中Na2SO4溶液换成CuSO4溶液,现象与原实验II中的现象相同
【答案】D
【解析】
A. 显红色的酚酞,Ba(OH)2溶液显碱性,滴加盐酸,发生酸碱中和反应:H+ + OH- =H2O溶液红色褪去,故A不符合题意;
B. Ba(OH)2 与Na2SO4发生复分解反应:Ba(OH)2 +Na2SO4= BaSO4↓ + 2NaOH,溶液中依然存在有大量的Na+与OH-,故B不符合题意;
C. H2SO4 与Ba(OH)2发生复分解反应:Ba2+ + 2OH- + 2H+ + SO42- == BaSO4↓+ 2H2O,溶液中离子浓度减小,灯泡变暗,氢氧根浓度逐渐减小,红色逐渐褪去,故C不符合题意;
D. CuSO4 与Ba(OH)2发生复分解反应:Ba(OH)2 +CuSO4= BaSO4↓ + Cu(OH)2 ↓,溶液中离子浓度逐渐减小,灯泡逐渐变暗,氢氧根浓度逐渐减小,红色逐渐褪去,与Na2SO4的实验现象不同,故D符合题意;
综上所述,本题应选D。