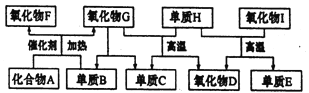
题目内容
【题目】某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol·L-1的溶液。在FeCl2溶液中需加入少量铁屑,其目的是___________。
(2)甲组同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为____________。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mL FeCl2溶液中先加入0.5 mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是_____。
(4)丙组同学取10 mL 0.1 mol·L-1 KI溶液,加入6 mL 0.1 mol·L-1 FeCl3溶液混合。分别取2 mL 此溶液于3支试管中进行如下实验:
①第一支试管中加入1 mL CCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是____(填离子符号);实验①和③说明:在I-过量的情况下,
溶液中仍含有___(填离子符号),由此可以证明该氧化还原反应为________。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为___________________;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成。产生气泡的原因是_______________;生成沉淀的原因是__________________(用平衡移动原理解释)。
【答案】 防止Fe2+被氧化 2Fe2++Cl2=2Fe3++2Cl- 隔绝空气(排除氧气对实验的影响) Fe2+ Fe3+ 可逆反应 2Fe2++H2O2+2H+=2Fe3++2H2O Fe3+催化H2O2分解产生O2 H2O2分解反应放热,促进Fe3+的水解平衡正向移动
【解析】试题分析:(1)Fe2+容易被氧气氧化成Fe3+,Fe+2Fe3+=3Fe2+,为防止Fe2+被氧化,保存Fe2+时,加入铁屑;(2)氯气具有强氧化性,能把Fe2+氧化成Fe3+,因此离子反应方程式为2Fe2++Cl2=2Fe3++2Cl-;(3)为防止空气氧气进入,煤油的作用是隔绝空气;(4)K3[Fe(CN)6]检验Fe2+,如果出现蓝色沉淀,说明Fe2+存在,可逆反应特点是反应物和生成物共存,因此在I-过量,溶液中仍然存在Fe3+,说明此反应是可逆反应;(5)过氧化氢具有强氧化性,能把Fe2+氧化成Fe3+,本身被还原为H2O,因此离子反应方程式为:2Fe2+ +H2O2+2H+=2Fe3++2H2O,Fe3+作催化剂,加速过氧化氢的分解,根据实验现象,一段时间后有气泡冒出且放热,说明此反应是放热反应,Fe3++3H2O![]() Fe(OH)3+3H+,盐类水解是吸热反应,升高温度,促使平衡向正反应方向进行,因此有红褐色沉淀产生。
Fe(OH)3+3H+,盐类水解是吸热反应,升高温度,促使平衡向正反应方向进行,因此有红褐色沉淀产生。

【题目】下列实验现象及所对应的离子方程式都正确的是( )

选项 | 现象 | 离子方程式 |
A | I在空气中放置一段时间后,溶液呈蓝色 | 4I-+O2+2H2O=2I2+4OH- |
B | II溶液由浅绿色变为红色 | Fe2++Cl2=Fe3++2Cl- Fe3++3SCN-=Fe(SCN)3 |
C | III溶液 颜色无变化 | Cl2+2OH- = Cl-+ClO-+H2O |
D | IV有白色沉淀生成,溶液由红色变无色 | Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O |