题目内容
【题目】ClO2气体是一种优良的消毒剂,常用于自来水的消毒。已知:NaClO2饱和溶液在低于38℃时析出NaClO23H2O,高于38℃时析出NaClO2。
(1)工业上常将ClO2制备成NaClO2固体以便运输和贮存,流程如下:

①吸收器中,H2O2的作用是____。(填“氧化剂”或“还原剂”)。
②在吸收器反应时应控制温度低于5℃的原因是:____。
③操作a:55℃蒸发至有大量晶体析出、____、用介于38℃~60℃的温水洗涤、低于60℃干燥,得到NaClO2固体。
(2)将ClO2溶于水得到溶液,为测定其浓度,进行以下实验操作:
步骤1:取待测ClO2溶液20.00mL于锥形瓶中;
步骤2:用稀H2SO4调节溶液pH <2.0,加入足量的KI晶体充分反应;
步骤3:加入几滴淀粉溶液,逐滴加入0.1 mol· L-1的Na2S2O3溶液,恰好完全反应时,消耗Na2S2O3溶液20.00mL;
已知:2ClO2+10KI+4H2SO4=2KCl+5I2+4K2SO4+4H2O,I2+2Na2S2O3=Na2S4O6+2NaI,试计算溶液中ClO2的物质的量浓度(写出计算过程)。____
【答案】还原剂 防止温度过高H2O2分解,或ClO2气体溶解度随温度升高而降低(答出一点即可) 趁热过滤 0.02mol· L-1
【解析】
(1)ClO2与氢氧化钠溶液和过氧化氢发生氧化还原反应生成NaClO2,55℃蒸发至有大量晶体析出,趁热过滤(因为低于38℃时析出NaClO23H2O),用介于38℃~60℃的温水洗涤、低于60℃干燥,得到NaClO2固体。
(2)利用氧化还原反应得失电子数相等列关系式解题。
(1)吸收器中反应2ClO2+H2O2+2NaOH===2NaClO2+O2↑+2H2O,ClO2中氯元素化合价降低,得电子为氧化剂,H2O2中氧元素化合价升高,失电子为还原剂;吸收器中温度不可太高,因为温度过高H2O2分解, ClO2气体溶解度随温度升高而降低;NaClO2饱和溶液在低于38℃时析出NaClO23H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl,若要得到NaClO2晶体,需在38-60℃得到晶体,故操作为趁热过滤,用38-60℃的温水洗涤,低于60℃干燥,得到NaClO2固体。
正确答案:还原剂;防止温度过高H2O2分解,或ClO2气体溶解度随温度升高而降低(答出一点即可);趁热过滤。
(2)根据2ClO2+10KI+4H2SO4=2KCl+5I2+4K2SO4+4H2O,I2+2Na2S2O3=Na2S4O6+2NaI
可知ClO2~5Na2S2O3,列等式5c(ClO2)×V(ClO2)= C(Na2S2O3)×V(Na2S2O3),
5×c(ClO2)×20.00×10-3=0.1×20.00×10-3,得c(ClO2)=0.02mol· L-1.
正确答案:0.02mol·L-1。

 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
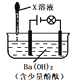
黄冈360度定制密卷系列答案【题目】滴有酚酞的Ba(OH)2溶液显红色,在上述溶液中分别滴加X溶液后有下列现象。下列说法不正确的是
序号 | 装置 | X溶液 | 现象 |
I |
| 盐酸 | 溶液红色褪去,无沉淀,灯泡亮度没有明显变化 |
II | Na2SO4 | 溶液红色不变,有白色沉淀生成,灯泡亮度没有明显变化 | |
III | H2SO4 | 溶液红色褪去,有白色沉淀生成,灯泡逐渐变暗 |
A. 实验I中溶液红色褪去,说明发生了反应H+ + OH- =H2O
B. 实验II中溶液红色不变,且灯泡亮度没有明显变化,说明溶液中依然存在有大量的Na+与OH-
C. 实验III中溶液红色褪去,有白色沉淀生成,灯泡逐渐变暗,说明发生了反应Ba2+ + 2OH- + 2H+ + SO42- == BaSO4↓+ 2H2O
D. 将实验II中Na2SO4溶液换成CuSO4溶液,现象与原实验II中的现象相同